4 МАЛИЙ ПРАКТИКУМ. ЯКІСНІ РЕАКЦІЇ НА ДЕЯКІ КЛАСИ ОРГАНІЧНИХ СПОЛУК
Малий органічний практикум розрахований на визначення найважливіших класів органічних сполук за допомогою якісних реакцій на функціональні групи. Класифікація основних органічних сполук наведена на рис. 4.1. Класи сполук, наведені на рис. 4.1, утворюють відповідні гомологічні ряди.

Перша особливість цього розділу полягає в тому, що, в першу чергу, для виявлення функціональних груп використовуються не фізичні та фізико-хімічні методи (інфрачервона спектроскопія, спектроскопія в ультрафіолетовій та видимій частинах спектра, спектроскопія протонного магнітного резонансу, газова та газорідинна хроматографія), а хімічні методи. Це дозволяє не лише практично закріпити набуті на лекціях та семінарах теоретичні знання, а й знайти їм практичне застосування при первинній ідентифікації (identification), наприклад, неопізнаних та змішаних пестицидних препаратів та іншої вторинної промислової сировини, яка зараз не використовується.
Друга особливість полягає в тому, що біологічна активність пести-цидних препаратів визначається, як правило, наявністю функціональних груп в органічній молекулі та їх просторовою будовою. Вперше спроба класифікувати пестицидні препарати за класами органічних сполук була здійснена Мельниковим М. М. Вона виявилась вдалою і зараз широко використовується як в Україні, так і за кордоном. При цьому діючі речовини сучасних пестицидних препаратів відносяться до таких класів органічних сполук [36]:
- - галогенопохідні аліфатичних, аліциклічних та ароматичних вуг-леводнів;
- - нітро-, аміносполуки та четвертинні амонієві солі;
- - спирти, феноли;
- - етери та естери органічних кислот;
- - альдегіди, кетони та хінони;
- - аліфатичні, аліциклічні, ароматичні та арилоксикарбонові кис-лоти та їх похідні;
- - похідні карбонатної та карбамінової кислот;
- - похідні тіо- та дитіокарбамінової кислот;
- - похідні сечовини та тіосечовини (thiourea);
- - гетероциклічні сполуки;
- - органічні сполуки меркурію, стануму, силіцію, плюмбуму, германію, арсену, стибію, бісмуту, феруму, фосфору та бору.
Третя особливість розділу полягає в тому, що якісні реакції лише на одну функціональну групу зустрічаються досить рідко, тому для визначення певної функціональної групи, як правило, використовують декілька реакцій, які доповнюють одна одну.
4.1 Вуглеводні
4.1.1 Насичені вуглеводні (алкани)
Насичені вуглеводні (гексан, октан та інші) вступають в реакцію галогенування при опроміненні реакційної маси світлом кварцової лампи.

Розчин брому, як правило, готують у тетрахлорметані або хлоро-формі у співвідношенні розчинник : бром = 50 : 1 або 100 : 1.
Дослід 1. Реакція з бромом
В дві сухі пробірки вносять по 1 мл проби насиченого вуглеводню, додають 10 крапель розчину брому, наприклад, в тетрахлорметані і легко струшують реакційну масу в пробірках. Потім першу пробірку ставлять в темне місце на 10 хвилин (контрольний дослід, реакція 2 за наведеною схемою), а реакційну масу другої пробірки опромінюють світлом кварцової лампи (реакція 1, бромування) протягом 10 хвилин. Потім порівнюють зміни в обох пробірках.
4.1.2 Ненасичені вуглеводні (алкени)
Дослід 2. Реакція ненасичених сполук з бромом
Більшість сполук, які містять кратні зв’язки (подвійний, потрійний, їх комбінації, за винятком ароматичних систем), легко приєднують бром:

Реакцію, як правило, проводять у розчині тетрахлорметану, хлороформу або оцтової кислоти.
В суху пробірку вносять 1 – 2 краплі проби ненасиченого вуглеводню, додають 1 – 2 краплі розчину брому в хлороформі (або оцтовій кислоті) і легко струшують пробірку. При наявності у пробі речовини із кратним зв’язком розчин миттєво знебарвлюється. Для демонстрації реакції зручно використовувати олеїнову кислоту, аліловий спирт, циклогексадієн.
Інші класи сполук, які містять рухомі атоми Гідрогену, що легко заміщуються на Бром (анілін, фенол, деякі третинні вуглеводні), також знебарвлюють розчин брому. Однак при цьому виділяється бромоводень, який легко виявити з допомогою вологого лакмусового паперу:

Вологий лакмусовий папір червоніє, що вказує на виділення «кис-лої» пари HBr.
Реакцію ненасичених вуглеводнів з бромом слід доповнювати (дублювати) реакцією з калій перманганатом (permanganate).
Дослід 3. Реакція ненасичених сполук з калій перманганатом
У слабкокислому середовищі калій перманганат окиснює подвійний зв’язок більшості сполук до гліколей (реакція Вагнера), відновлюючись при цьому до манган(ІV) оксиду:

В пробірку вносять 1 краплю рідкого алкену, додають 1 краплю 0,5М розчину натрій карбонату і при енергійному струшуванні додають 2 - 3 краплі розчину калій перманганату. При наявності кратного зв’язку фіолетове забарвлення останнього миттєво зникає і з’являється коричневий осад манган(ІV) оксиду. Якщо ненасичений вуглеводень нерозчинний у воді, то у цьому випадку як розчинник використовують піридин або ацетон.
Інші ненасичені вуглеводні (алкіни, алкадієни) також вступають в реакції з бромом та калій перманганатом. Тому для виявлення кінцевого потрійного (-С ≡ CH) зв’язку в алкінах застосовують специфічні реакції з аміакатами купруму(І) та арґентуму(І).
4.1.3 Ненасичені вуглеводні (алкіни)
Дослід 4. Утворення аргентум(І) ацетиленіду
У пробірку вносять 2 краплі аргентум(І) нітрату і додають 1 краплю розчину амоніаку – утворюється бурий осад аргентум(І) гідроксиду. При доданні 1 2 крапель розчину амоніаку осад AgOH легко розчиняється з утворенням амоніачного розчину аргентум(І) оксиду:

Для отримання ацетилену у пробірку з газовідвідною трубкою вносять 3 – 4 г кальцій карбіду, додають 10 мл води та закривають пробкою:

Через амоніачний розчин аргентум(І) гідроксиду пропускають ацетилен (алкін). Утворюється білий осад аргентум(І) ацетиленіду:

У водних розчинах ацетиленіди аргентуму(І) та купруму(І) - стійкі. У сухому стані при нагріванні або ударі – це вибухові речовини.
Реакції утворення купрум(І) та аргентум(І) ацетиленідів є якісними реакціями на кінцевий потрійний зв´язок (-С ≡ CH).
4.1.4 Ненасичені сполуки (арени)
Дослід 6. Взаємодія аренів з трихлорметаном
Ароматичні вуглеводні можна виявити дуже чутливою реакцією – дією трихлорметану (хлороформу) в присутності безводного алюміній хлориду:

Арени з одним бензольним ядром утворюють сполуки червоно-оранжевого кольору, з двома конденсованими ядрами (нафталін) – сполуки синього кольору, з трьома ядрами (антрацен) – сполуки зеленого кольору.
Дослід 7. Формалінова реакція аренів
Більш доступною реакцією на арени є формалінова реакція. При дії на сліди досліджуваної ароматичної речовини концентрованою сульфатною кислотою та формаліном випадають кольорові осади внаслідок утворення хіноїдної структури:

Бензол та його гомологи (толуол, ксилол) утворюють червоні осади, нафталін – світло-зелений.
4.1.5 Лабораторна робота.
Якісний функціональний аналіз вуглеводнів на наявність простого, подвійного, потрійного та ароматичного зв’язків у складі органічних речовин
Завдання 1. Виконати досліди 1 – 7. Довести наявність простого, подвійного, потрійного та ароматичного зв’язків в органічних сполуках. Результати дослідів занести до табл. 4.1.

Завдання 2. Використовуючи вміння та навички, отримані при виконанні попереднього завдання, запропонувати якісні реакції для виявлення сполук а, б, в, г, д відповідно до свого варіанта (табл. 4.2). Навести схеми відповідних реакцій.

.png)
Контрольні запитання
1. Якою реакцією можна довести, що насичені вуглеводні (алкани (al-kanes), парафіни) не вступають в реакцію бромування за звичайних умов? За яких умов можливе бромування? Наведіть відповідні рівняння реакцій.
2. Наведіть якісну реакцію на ненасичені вуглеводні (алкени). Що при цьому відбувається?
3. Чи можна розрізнити алкани, алкени та алкіни реакцією з бромом? Наведіть відповідні рівняння реакцій.
4. Як взаємодіють алкени за реакцією Вагнера?
5. Чому при виявленні алкенів реакцію з бромом слід доповнювати реакцією з калій перманганатом?
6. Про наявність якої з двох речовин – алілового спирту чи фенолу – свідчить знебарвлення розчину брому та почервоніння вологого лакмусового паперу, розміщеного над отвором пробірки?
7. Синтез реактиву Толленса та його дія на ненасичені вуглеводні (алкі-ни). Наведіть відповідні рівняння реакцій.
8. Як виявляють кінцевий потрійний зв’язок в алкінах? Наведіть відповідні рівняння реакцій.
9. Як взаємодіють арени з трихлорметаном? Як змінюється колір реакційної маси при проведенні якісної реакції на конденсовані ароматичні сполуки?
10. Виявлення бензолу формаліновою реакцією. Наведіть рівняння реакції. Що при цьому спостерігають?
4.2 Оксигеновмісні сполуки
4.2.1 Встановлення гідроксильної групи (спирти, феноли)
Дослід 8. Реакція з металевим натрієм
Одноатомні спирти, які містять 3 - 8 атомів Карбону, легко виявляють реакцією з металевим натрієм:

До 2 - 3 крапель безводної проби одноатомного спирту обережно додають шматочок (0,05 г) натрію. Виділення водню, яке супроводжується розчиненням металевого натрію, вказує на наявність активного атома Гідрогену в складі гідроксильної групи спиртів.
Дослід 9. Реакція з сірковуглецем на первинні та вторинні гідроксильні групи (ксантогенова реакція)
Первинні та вторинні спирти в присутності лугів реагують з сірковуглецем, утворюючи розчинні у воді солі алкілксантогенатів [37, 38]:

Солі алкілксантогенатів у реакції з водними розчинами солей купруму(ІІ) утворюють коричневі осади купрум(І) ксантогенатів:

Для визначення третинних спиртів ця реакція непридатна.
Пробу досліджуваної речовини (спирту) розчиняють в 1 мл етеру. Додають 1 краплю CS2 та кілька крупинок натрій гідроксиду. Суміш перемішують і трохи підігрівають на водяній бані. Додають краплю 2 %-го розчину купрум(II) сульфату. При наявності у пробі гідроксильної групи утворюється коричневий осад купрум(І) ксантогенату.
Дослід 10. Окиснення спиртових гідроксильних груп хромовою сумішшю
В суху пробірку додають 2 краплі етилового спирту, 1 краплю 1М розчину сульфатної кислоти і 2 краплі 0,1М розчину калій дихромату. Нагрівають оранжевий розчин до зміни забарвлення на синьо-зелене:

Дослід 11. Реакція на багатоатомні спирти
Більшість багатоатомних спиртів утворюють хелати – купрум(ІІ) гліколяти, які добре розчинні у воді і мають яскраво-синє забарвлення:

У пробірку вносять кілька крапель 3 %-го розчину СuSO4-5Н2О та 3 – 5 крапель 5 %-го розчину NaOH – утворюється блакитний осад куп-рум(ІІ) гідроксиду. Додають 3 краплі досліджуваної проби (гліцерин, етиленгліколь), осад швидко розчиняється і розчин набуває інтенсивного синього кольору.
З розчином солі купруму(ІІ) α-амінокислоти та α-аміноспирти теж утворюють розчинні сполуки синього кольору.
Дослід 12. Реакція на феноли
Більшість фенолів дає інтенсивне забарвлення з розчином ферум(ІІІ) хлориду за рахунок утворення комплексних сполук (complex compounds) феруму(ІІІ).
Забарвлення, як правило, синє або фіолетове. У складних фенолів, що мають замісники у ядрі, воно буває зеленим або червоним.

У пробірці розчиняють кілька кристалів або одну краплю проби фенолу в 1 мл води або хлороформу. При струшуванні додають 1 краплю 1 %-го водного розчину ферум(ІІІ) хлориду. При наявності фенольного гідроксилу миттєво з’являється інтенсивне забарвлення.
4.2.2 Встановлення карбонільної групи (альдегіди, кетони)
Дослід 13. Реакція з 2,4-динітрофенілгідразином
Загальною реакцією на альдегіди і кетони є утворення похідних 2,4-динітрофенілгідразину (ДНФГ):

Похідні ДНФГ, які утворюються в цій реакції, погано розчинні у воді і випадають у вигляді яскраво-жовтих осадів.
У пробірку з 2 мл 2 %-го розчину 2,4-динітрофенілгідразину в оцтовій кислоті додають розчин 0,02 г проби (карбонільної сполуки) в 2 мл етанолу. Суміш нагрівають на водяній бані, потім охолоджують. Похідні 2,4-динітрофенілгідразину утворюють яскраво-жовтий осад.
Ще однією реакцією на альдегіди можна вважати реакцію ареналь-арилімінів (основ Шиффа) на фільтрувальному папері з ДНФГ або 4-ди-метиламінобензальдегідом за схемами [39]:


У пробірку вносять 0,02 г основи Шиффа, потім додають 5 мл етанолу, перемішують зі слабким нагріванням до повного розчинення твердої речовини. На смужку фільтрувального паперу наносять краплю отриманого спиртового розчину і витримують над відкритою склянкою з концентрованою хлоридною кислотою впродовж 5 – 7 с. Далі на фільтрувальний папір наносять розчин 2,4-динітрофенілгідразину або 4-диметиламіно-бензальдегіду та спостерігають утворення яскравої жовто-оранжевої плями.
Дослід 14. Реакція з гідрогенхлоридом гідроксиламіну
Оскільки гідрогенхлорид гідроксиламіну дає нейтральну реакцію, а оксим є досить слабкою основою, перебіг реакції контролюють за збільшенням кислотності середовища внаслідок виділення хлороводню.

До 2 мл 3 %-го розчину гідрогенхлориду гідроксиламіну додають 0,1 г проби досліджуваного альдегіду в 0,5 мл етанолу. Суміш нагрівають на водяній бані і додають 1 краплю метилоранжу. При наявності карбонільної групи (carbonyl group) утворюється оксим, виділяється хлороводень і спостерігається зміна забарвлення індикатора (indicators) на червоне.
Дослід 15. Реакція “срібного дзеркала” (реакція Толленса)
У чисту пробірку вносять 2 краплі 0,1М розчину арґентум(І) нітрату і додають 1 краплю розчину амоніаку. Бурий осад арґентум(І) гідроксиду розчиняють при доданні 2 3 крапель розчину амоніаку. До отриманого розчину додають кілька краплин 5 %-го розчину формальдегіду та занурюють пробірку на декілька хвилин у водяну баню з температурою води 60 – 70 °С. Спостерігають виділення металевого срібла у вигляді блискучої дзеркальної плівки. Ця реакція є якісною на альдегідну групу.

Дослід 16. Окиснення альдегідів купрум(ІІ) гідроксидом
У пробірку вносять 4 краплі натрій гідроксиду, розбавляють 4 краплями води і додають 2 краплі розчину купрум(ІІ) сульфату. До осаду купрум(ІІ) гідроксиду додають 2 краплі розчину формальдегіду і струшують вміст пробірки. Нагрівають до кипіння верхню частину пробірки, залишаючи нижню холодною для контролю. У нагрітій частині пробірки виділяється жовтий осад купрум(І) гідроксиду, який перетворюється у червоно-коричневий осад купрум(І) оксиду за схемою:

Дослід 17. Реакція з фуксинсульфітною кислотою
Якісною реакцією на альдегіди є реакція з фуксинсульфітною кислотою. Її добувають дією сульфітної кислоти на розчин фуксину:

Для отримання Н2SO3 в пробірку з газовідвідною трубкою, кінець якої занурюють в ємність з дистильованою водою, вносять 0,5 – 1 г кристалічного натрій сульфіту і додають 3 – 4 краплини концентрованої сульфатної кислоти.
Фуксин – яскраво-червоний трифенілметановий барвник – знебарвлюється сульфітною кислотою внаслідок руйнування хіноїдної структури. Після додавання альдегіду до безбарвного розчину фуксинсульфітної кислоти з’являється фіолетове або синє забарвлення:

В пробірку вносять 2 – 4 краплини фуксинсульфітної кислоти, яку попередньо отримують пропусканням SO2 через 0,1 %-й розчину фуксину до знебарвлення. Потім додають 2 – 4 краплини розчину формальдегіду. Поступово з’являється фіолетове забарвлення.
4.2.3 Встановлення карбоксильної групи (карбонові кислоти)
Дослід 18. Виявлення карбонових кислот. Порівняння ступенів дисоціації карбонових кислот
У окремі пробірки вносять по кілька крапель (або кристалів) оц-тової, трихлороцтової, щавлевої, бурштинової, бензойної та саліцилової кислот і додають в кожну по 2 мл води. Якщо кислота не розчиняється, пробірку нагрівають. Чистою скляною паличкою розчин кожної кислоти наносять на сухий індикаторний папір (конго-червоний). Спостерігають появу забарвлених смуг різної інтенсивності.
Інтервал переходу конго-червоного рН = 3,0 – 5,0 (синій – червоний). При дії слабких кислот з’являється коричнево-чорне забарвлення, більш сильних – синьо-чорне, сильних – стійке сине забарвлення. Досліджені кислоти розташовують у ряд зростання сили кислот.
Дослід 19. Реакція карбонових кислот з натрій гідрогенкарбонатом
Для виявлення карбонових кислот часто застосовують їх взаємодію з натрій гідрогенкарбонатом.
У кілька пробірок вміщують по 5 крапель розчинів кислот (оцтової, трихлорооцтової, щавлевої, бурштинової, бензойної, саліцилової тощо) і додають по 2 краплі 5 %-го розчину натрій гідрогенкарбонату. Спостерігають бурхливе виділення бульбашок газу – карбон(ІV) оксиду:

4.2.4 Лабораторна робота.
Якісний функціональний аналіз оксигеновмісних сполук
Завдання 1. Виконати дослід 8 – 17. Виявити функціональні групи (–ОН, –СОН, –СООН) в органічних сполуках. Результати дослідів занести до табл. 4.3.

Завдання 2. Використовуючи вміння та навички, отримані при ви-конанні попереднього завдання, запропонувати якісні реакції для виявлення сполук а, б, в, г, д відповідно до свого варіанта (табл. 4.4). Навести схеми відповідних реакцій.

.png)
Контрольні запитання
1. Якими реакціями можна відрізнити первинні та вторинні спирти від третинних?
2. Якою реакцією можна довести, що досліджувана речовина є: а) одноатомним спиртом; б) багатоатомним спиртом? Наведіть відповідні рівняння реакцій.
3. Наведіть рівняння реакції та назвіть продукт окиснення н-пропанолу хромовою сумішшю (chrome mixture).
4. Який реагент використовують для виявлення фенолів? Які зовнішні ефекти при цьому спостерігають?
5. При взаємодії з яким реагентом альдегіди та кетони утворюють яскраво-жовті осади? Наведіть рівняння реакції.
6. З якою метою додають метилоранж при виявленні альдегідів реакцією з гідрогенхлоридом гідроксиламіну?
7. Які окисно-відновні реакції використовують для виявлення альдегід-ної групи в органічних сполуках? Наведіть відповідні рівняння реак-цій.
8. Наведіть рівняння реакцій взаємодії купрум(ІІ) гідроксиду з етилен-гліколем та етаналем. Чи однакові зовнішні ефекти при цьому спо-стерігаються?
9. Що спостерігають при виявленні карбонових кислот взаємодією з натрій гідрогенкарбонатом? Наведіть рівняння реакції.
10. Поясніть, чи можна за допомогою фенолфталеїну (індикатор змі-нює своє забарвлення в інтервалі pH 8,2 – 9,8 з безбарвного на мали-новий) довести наявність у розчині оцтової кислоти.
4.3 Нітрогеновмісні сполуки
4.3.1 Встановлення аміногрупи (аліфатичні та ароматичні аміни)
Дослід 20. Реакція з водними розчинами ферум(ІІІ) хлориду та купрум(ІІ) сульфату
В одну пробірку вносять 2 мл розчину ферум(ІІІ) хлориду, в іншу – 2 мл розчину купрум(ІІ) сульфату. Через кожний з розчинів пропускають газоподібний метиламін. У першій пробірці утворюється осад ферум(ІІІ) гідроксиду, у другій – купрум(ІІ) гідроксиду:

Утворення гідроксидів феруму(ІІІ) та купруму(ІІ) вказує на те, що аміни у водному розчині утворюють гідрати, які дисоціюють як основи.
Дослід 21. Реакція аліфатичних амінів з нітритною кислотою
Первинні аміни можна відрізнити від вторинних, третинних та ароматичних за їх реакцією з нітритною кислотою – відбувається виділення азоту та утворення відповідного спирту.
У пробірці змішують 0,2 г солі аміну з 1 мл води та 10 %-го розчину натрій нітриту. До суміші додають 2 3 краплі концентрованої оцтової кислоти та спостерігають інтенсивне виділення бульбашок азоту:

Дослід 22. Ізонітрильна реакція на аліфатичні аміни
Первинні аміни вступають у реакцію з хлороформом у лужному середовищі з утворенням ізонітрилів, які мають різкий неприємний запах.
У пробірку (витяжна шафа!) вносять кілька крупинок гідрохло-риду метиламіну, додають 2 3 краплі хлороформу та 1 мл 15 %-го розчину калій гідроксиду. При обережному нагріванні починається енергійна реакція з утворенням ізонітрилу, який визначають за характерним запахом:

Дослід 23. Ізонітрильна реакція на ароматичні аміни
У пробірку вносять 5 крапель аніліну, 10 - 15 крапель 10 %-го розчину натрій гідроксиду, 10 крапель хлороформу і 50 крапель етанолу. При повільному нагріванні суміші до кипіння з’являється характерний неприємний запах ізонітрилу. Реакція проходить за схемою:

Перед тим, як вилити розчин бензоізонітрилу в склянку для зливу, його краще гідролізувати за схемою:

Для цього в пробірку додають 5 мл 10 %-го розчину сульфатної кислоти і кип’ятять суміш до зникнення характерного запаху ізонітрилу.
Таким чином, ізонітрильна реакція використовується для ідентифі-кації первинних амінів аліфатичного та ароматичного рядів.
4.3.2 Встановлення карбамідної групи (аміди, сечовини)
Дослід 24. Гідроліз ацетаміду
Декілька кристаликів ацетаміду вносять в пробірку, до якої до-дають 10 крапель 1М розчину натрій гідроксиду. Гідроліз відбувається за схемою:

Різкий амоніачний запах та синє забарвлення вологого лакмусового паперу вказують на гідроліз ацетаміду за наведеною схемою.
Дослід 25. Гідроліз сечовини
Один мікрошпатель сечовини вносять в пробірку, до якої додають 5 - 6 крапель баритової води. Не щільно закривають пробірку гумовою пробкою, між пробіркою та пробкою розміщують лакмусовий папір. Пробірку вносять в нагріту водяну баню. Гідроліз сечовини відбувається за схемою:

Зміна через 10 - 15 хвилин забарвлення вологого лакмусового паперу вказує на виділення амоніаку, а утворення білого мутного розчину - на утворення барій карбонату.
Таким чином, реакція лужного гідролізу використовується для ідентифікації нітрогеновмісних органічних сполук, що мають у своєму складі карбамідну групу.
4.3.3 Якісні реакції на амінокислоти (α-амінокислоти)
Дослід 26. Визначення реакції середовища у водному розчині гліцину
За допомогою смужки універсального індикаторного паперу визначають рН 1 %-го розчину гліцину. Відсутність кислої реакції розчину гліцину пояснюється утворенням внутрішньомолекулярної солі (цвітер-іона):
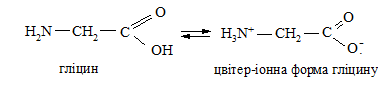
Дослід 27. Реакція гліцину з купрум(II) сульфатом
У пробірку вносять по 0,5 мл 2 %-го розчину купрум(II) сульфату та 1 %-го розчину гліцину. Утворюється стійка внутрішньомолекулярна комплексна сполука синього кольору:

Сульфатна кислота, яка виділяється в процесі, не руйнує комплекс. При подальшому додаванні 5 - 10 крапель 10 %-го розчину натрій гідроксиду до комплексу змін не відбувається, оскільки сіль гліцину стійка як в кислому, так і в лужному середовищах.
Дослід 28. Взаємодія α-амінокислот з формальдегідом
У пробірку вносять 3 краплі 40 %-го водного розчину формальде-гіду та 1 краплю індикатора метилового червоного. Спостерігають появу червоного забарвлення розчину, яке свідчить про наявність кислого середовища.
Піпеткою в пробірку краплями додають 10 %-й водний розчин на-трій гідроксиду до нейтральної реакції. Спостерігають появу жовтого забарвлення розчину. Добутий нейтралізований розчин формальдегіду змішують з 3 краплями 1 %-го водного розчину гліцину і спостерігають появу червоного забарвлення (кисле середовище):

Якісна реакція ґрунтується на блокуванні формальдегідом аміногрупи кислоти.
Дослід 29. Взаємодія α-амінокислот з нінгідрином
У пробірку вносять 2 краплі 0,1 %-го розчину нінгідрину та 4 краплі 1 %-го розчину α-амінокислоти. Суміш нагрівають до кипіння і спостерігають появу синьо-фіолетового забарвлення розчину:

Нінгідринна реакція застосовується для якісного визначення α-амінокислот.
4.3.4 Лабораторна робота.
Якісний функціональний аналіз нітрогеновмісних сполук
Завдання 1. Виконати досліди 20 – 29. Виявити функціональні групи -NH2; -C(=O)NH2; -C(NH2)COOH в досліджуваних органічних сполуках, результати дослідів занести до табл. 4.5.

Завдання 2. Використовуючи вміння та навички, отримані при ви-конанні попереднього завдання, запропонувати якісні реакції для виявлення сполук а, б, в, г відповідно до свого варіанта (табл. 4.6). Навести схеми відповідних реакцій.
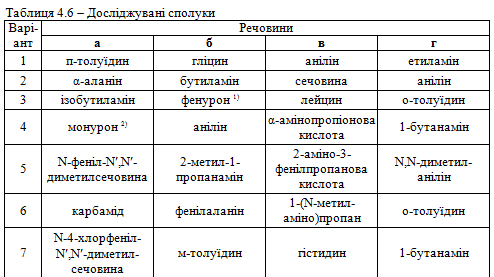
.png)
Контрольні запитання
1. Якою є реакція середовища (рН) у водних розчинах амінів? Якимиреакціями це можна довести? Наведіть відповідні рівняння реакцій.
2. Якими реакціями можна відрізнити первинні аміни від вторинних та третинних? Наведіть відповідні рівняння реакцій.
3. Чи можна використовувати ізонітрильну реакцію для того, щоб розрізнити первинні аліфатичні та ароматичні аміни?
4. Якою реакцією можна розрізнити первинні аліфатичні та ароматичні аміни?
5. На наявність якої функціональної групи у складі нітрогеновмісних органічних речовин вказує поява характерного запаху амоніаку та посиніння вологого лакмусового паперу після додання розчину натрій гідроксиду? Наведіть рівняння реакції.
6. Які газоподібні продукти реакції утворюються при лужному гідролізі сечовини? За якими зовнішніми ознаками роблять висновок про їх виділення? Наведіть відповідні рівняння реакцій.
7. Які продукти утворюються при взаємодії α-амінокислот з розчином купрум(ІІ) сульфату?
8. Яке забарвлення буде мати метиловий червоний (індикатор змінює своє забарвлення в інтервалі pH 4,4 – 6,2 з червоного на жовтий) у розчині амінокислоти? Чи зміниться забарвлення індикатора після додання формальдегіду? Відповідь поясніть.
9. Чи можна за допомогою відповідних кислотно-основних індикаторів (або універсального індикаторного паперу) визначити, яка з двох кислот – оцтова чи α-амінооцтова кислота міститься у розчині?
10. Які кольорові якісні реакції застосовують для виявлення α-аміно-кислот?
4.4 Сульфуровмісні сполуки
Деякі сульфуровмісні органічні сполуки можна розглядати як похідні від тіокарбонових кислот. Із усіх можливих тіокарбонових кислот у вільному стані лише тритіокарбонова кислота є стійкою. Однак відомі і інші похідні тіокарбонових кислот, які наведені нижче [15]:

Найбільш поширеними сульфуровмісними сполуками як похідними від розглянутих тіокарбонових кислот є тіоли (меркаптани (mercaptans), сульфіди, дисульфіди, тіосечовини, тіоаміди, ксантогенати, дитіокарбамати та тіурами. Деякі найбільш характерні реакції сульфуровмісних органічних сполук наведені нижче.
Дослід 30. Взаємодія плюмбум(ІІ) ацетату з меркаптанами (тіоспирти)
У пробірку вносять 3 – 5 крапель спиртового розчину етилмеркаптану, добавляють 3 – 5 крапель насиченого спиртового розчину плюмбум(ІІ) ацетату і спостерігають утворення жовтого осаду плюмбум(ІІ) етилмеркаптиду:

Дослід 31. Взаємодія меркурій(ІІ) ацетату з меркаптанами (тіоспирти)
У пробірку поміщають 3 – 5 крапель спиртового розчину етилмеркаптану, добавляють 3 – 5 крапель насиченого спиртового розчину меркурій(ІІ) ацетату і спостерігають утворення безбарвного осаду меркурій(ІІ) етилмеркаптиду:

Дослід 32. Взаємодія 4-бромофенацилброміду з сульфідами (тіоетери)
У пробірку вносять 3 – 5 крапель спиртового розчину діетилсульфіду, добавляють 5 крапель спиртового розчину 4-бромофенацилброміду і спостерігають утворення специфічної солі броміду діетил-4-бромо-фенацилбромідсульфонію:

Дослід 33. Гідроліз тіолоцтової кислоти (тіокарбонові кислоти)
Тіокарбонові кислоти при кип’ятінні з водою утворюють відповідні карбонові кислоти та сірководень:

Наявність різкого неприємного запаху сірководню та забарвлення лакмусового паперу у червоний колір вказують на присутність та гідроліз тіолкарбонової кислоти.
В суху пробірку вносять 1 – 2 краплі тіолоцтової (етантіолової) кислоти, додають 15 – 20 крапель води і нагрівають реакційну масу до кипіння. Далі за допомогою синього лакмусового паперу та смужки фільтрувального паперу, змоченого розчином плюмбум(ІІ) ацетату, доводять кислу реакцію отриманого розчину та виділення сірководню. За наявності плюмбум(ІІ) ацетату на смужці фільтрувального паперу утворюється чорний осад плюмбум(ІІ) сульфіду:

Дослід 34. Взаємодія купрум(ІІ) сульфату з метиловим О-естером дитіокарбонової кислоти (ксантогенати)
В суху пробірку вносять 1 – 2 краплі розчину ксантогенату в етиловому спирті, додають 1 краплю 5 %-го розчину натрій гідроксиду, 1 – 2 краплі 2 %-го розчину купрум(ІІ) сульфату. Утворюється коричневий осад купрум(І) ксантогенату за схемою:

Дослід 35. Взаємодія купрум(ІІ) сульфату з натрій N,N-диметил-дитіокарбаматом (солі дитіокарбамінових кислот)
В суху пробірку вносять 10 – 15 крапель водного розчину натрієвої солі N,N-диметилдитіокарбамінової кислоти і додають 5 крапель 2 %-го розчину купрум(ІІ) сульфату. Утворюється коричневий осад метал-хелату купруму(ІІ) за схемою [40]:

Дослід 36. Взаємодія купрум(ІІ) сульфату у лужно-сульфідному середовищі з тетраметилтіурамдисульфідом (тіурамсульфіди)
Тіурамсульфіди взаємодіють з натрій сульфідом у лужному середовищі з утворенням натрієвої солі діалкілдитіокарбамінової кислоти за схемою [40]:

При доданні до водного розчину натрієвої солі діалкілдитіокарбамінової кислоти водного розчину купрум(ІІ) сульфату випадає коричневий осад метал-хелату купруму(ІІ):

В суху пробірку вносять 10 – 15 крапель водного розчину тетраметил-тіурамдисульфіду, додають 10 крапель 5 %-го розчину натрій гідроксиду, 5 крапель розчину натрій сульфіду. Потім додають 5 крапель 2 %-го розчину купрум(ІІ) сульфату. Реакційну масу підігрівають до утворення коричневго осаду.
4.4.1 Лабораторна робота.
Якісний функціональний аналіз сульфуровмісних сполук
Завдання 1. Виконати досліди 30 – 36. Виявити функціональні групи -SH, -S-, -С(=S)OH, -OC(=S)OH, =NC(S)SH, -C(=S)SS(S=)C- в органічних сполуках, результати досліджень занести до табл. 4.7.
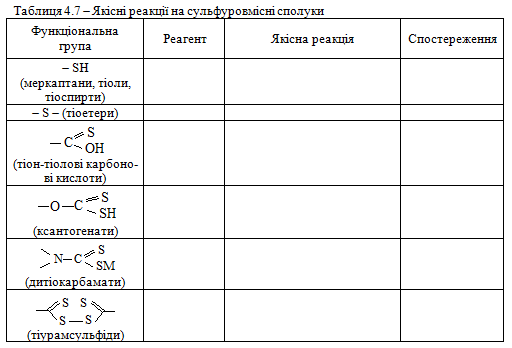
Завдання 2. Використовуючи вміння та навички, отримані при ви-конанні попереднього завдання, запропонувати якісні реакції для виявлення сполук а, б, в, г відповідно до свого варіанта (табл. 4.8). Навести схеми відповідних реакцій.
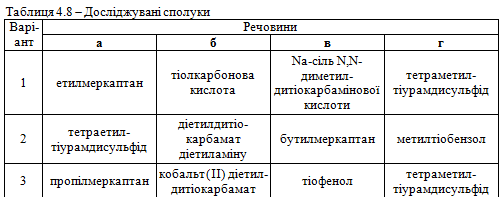
.png)
Контрольні запитання
1. Солі яких важких металів застосовують для виявлення тіоспиртів? Наведіть відповідні рівняння реакцій.
2. Наведіть рівняння реакції взаємодії метилмеркаптану з меркурій(ІІ) ацетатом.
3. Який реагент використовують для виявлення органічних сульфідів?
4. Які речовини утворюються при гідролізі пропантіолової кислоти? Наведіть рівняння реакції.
5. Які спостереження вказують на наявність тіолкарбонових кислот при кип’ятінні їх розчину?
6. Чому чорніє смужка фільтрувального паперу, попередньо оброблена розчином солі плюмбуму(ІІ) і розміщена над отвором пробірки, в яку був внесений розчин тіолкарбонової кислоти і нагрітий до кипіння? Наведіть рівняння реакції.
7. Які сульфурвмісні органічні сполуки можна виявити при дії розчину купрум(ІІ) сульфату?
8. Що відбувається при взаємодії ксантогенатів з розчином купрум(ІІ) сульфату? Наведіть рівняння реакції.
9. Як взаємодіють солі дитіокарбамінових кислот з розчином купрум(ІІ) сульфату? Наведіть рівняння реакції.
10. Які продукти утворюються при взаємодії тіурамсульфідів з натрій сульфідом у лужному середовищі? Наведіть рівняння реакції.
4.5 Вуглеводи
Дослід 37. Виявлення гідроксильних груп у вуглеводах
У пробірку вносять 6 крапель 10 %-го розчину натрій гідроксиду та 1 краплю 2 %-го розчину купрум(ІІ) сульфату. Спостерігають утворення синього осаду купрум(ІІ) гідроксиду. При доданні 1 краплі 0,5 %-го розчину D-глюкози осад швидко розчиняється з утворенням прозорого синього розчину купрум(ІІ) сахарату:

Ця реакція доводить наявність α-глікольного фрагмента у молекулі D-глюкози.
Дослід 38. Взаємодія моносахаридів з реактивом Фелінга
Реактив Фелінга – розчин купрум(ІІ) сульфату і сегнетової солі в 10 %-му розчині натрій гідроксиду. Його готують безпосередньо перед використанням.
У пробірку вносять 2 краплі водного розчину купрум(ІІ) сульфату (розчин А) та 2 краплі лужного розчину сегнетової солі – калій натрій тартрату (розчин Б). Спостерігають виділення блакитного осаду ку-прум(ІІ) гідроксиду, який зі сегнетовою сіллю утворює водорозчинний комплекс синього кольору:

Далі в пробірку додають 3 краплі 5 %-го розчину глюкози і нагрівають суміш до кипіння. Спостерігають поступове знебарвлення розчину та утворення червоно-коричневого осаду купрум(І) оксиду:


Дослід 39. Загальна реакція на вуглеводи з α-нафтолом (реакція Моліша)
У пробірку вносять кілька крупинок досліджуваного вуглеводу (глюкози, сахарози або крохмалю), 1 мл води та 2 краплі свіжоприготовленого 10 %-го спиртового розчину α-нафтолу. Пробірку струшують, потім нахиляють і обережно по стінці додають 1 мл концентрованої сульфатної кислоти (важкий шар кислоти повинен опуститися на дно пробірки, не змішуючись з водним шаром). На межі двох шарів спостерігають появу темно-фіолетового кільця, обумовленого утворенням продукту конденсації 5-гідроксиметилфурфуролу з α-нафтолом:

Ця реакція є загальною на всі вуглеводи (carbohydrates) та речовини, які їх містять.
Дослід 40. Нафторезорцинова проба Толленса
У пробірку вносять кілька крупинок глюкози, 5 мл води, 1 мл 1 %-го спиртового розчину нафторезорцину (1,3-дигідроксинафталіну) та 1 мл концентрованої хлоридної кислоти. Суміш обережно кип’ятять протягом 1 хв, потім обережно струшують з 5 мл етеру або бензолу. Етерний (бензольний) шар набуває різних відтінків: глюкоза, маноза, галактоза – синьо-зелене забарвлення; рамноза – фіолетове, арабіноза, ксилоза – темно-синє. Поява забарвлення обумовлена утворенням продуктів конденсації глюкуронової кислоти з нафторезорцином і утворенням похідних динафтилметану (формула І) або ксантену (формула ІІ):

Ця реакція є загальною на всі вуглеводи; вона часто застосовується для визначення уронових кислот.
Дослід 41. Відновлювальні властивості дисахаридів
1. У пробірку вносять 1 краплю 1%-го розчину лактози, 4 краплі 10 %-го розчину натрій гідроксиду та 1 краплю 2 %-го розчину купрум(ІІ) сульфату. Утворюється яскраво-блакитний осад купрум(ІІ) гідроксиду, який розчиняється при струшуванні пробірки. При цьому розчин стає прозоро-синім, внаслідок утворення комплексу купруму(ІІ) з лактозою:
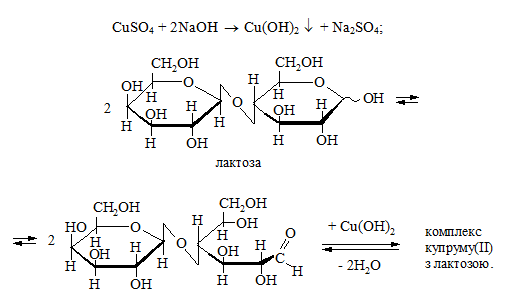
Потім у пробірку додають 2 мл води, струшують і обережно нагрівають верхню частину розчину. Спостерігають утворення осаду, забарвлення якого змінюється від жовтого до червоно-коричневого:

2. У пробірку вносять 1 краплю 1%-го розчину сахарози, 4 краплі10 %-го розчину натрій гідроксиду та 1 краплю 2 %-го розчину купрум(ІІ) сульфату. Яскраво-блакитний осад купрум(ІІ) гідроксиду розчиняється при струшуванні пробірки. Утворюється прозорий синій розчин комплексу купруму(ІІ) з сахарозою. Вміст пробірки нагрівають: жодних змін у пробірці не спостерігається, оскільки сахароза не має відновлювальних властивостей.
Дослід 42. Якісна реакція на крохмаль
У пробірку вносять 5 крапель 0,5 %-го розчину крохмального клейстеру та 1 краплю розчину йоду в калій іодиді. Спостерігають появу інтенсивно-синього забарвлення розчину. Вважають, що крохмаль утворює з йодом сполуки-включення (клатрати), забарвлені в характерні кольори – синій (λмакс = 620 – 680 нм) для амілози та червоний (λмакс = 520 – 555 нм) для амілопектину. Молекули амілози в цих комплексах утворюють навколо молекули йоду спіраль, кожний виток якої містить 6 залишків глюкози. При нагріванні забарвленого розчину крохмалю з йодом забарвлення зникає, а при охолодженні з’являється знову, що пов’язано, очевидно, з розкручуванням спіралі амілози (зміни просторової будови клатрату).
Дослід 43. Кислотний гідроліз крохмалю
При нагріванні розчину крохмалю з мінеральними кислотами відбувається його гідроліз з утворенням глюкози:

Глюкозу можна виявити характерними реакціями на моносахариди, наприклад, реакцією Троммера.
Реакція Троммера. Моносахариди, наприклад, глюкоза та фруктоза при нагріванні відновлюють купрум(ІІ) оксид в купрум(І) оксид, окиснюючись до альдольних кислот. Цю реакцію для глюкози в загальному вигляді можна записати таким рівнянням:
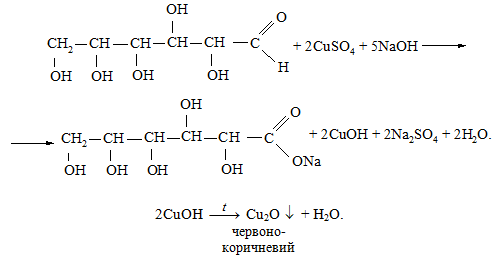
1. У пробірку до 3 мл 5 %-го розчину глюкози додають 1 мл 5 %-го розчину натрій гідроксиду, 1 мл 5 %-го купрум(ІІ) сульфату, який при перемішуванні розчиняється (розчин набуває блакитного забарвлення). При його обережному нагріванні до кипіння спостерігається утворення жовтого осаду купрум(І) гідроксиду або червоно-коричневого осаду купрум(І) оксиду.
2. У дві пробірки вносять по 5 мл розчину крохмалю. В одну з них додають також 2 – 3 краплі концентрованої хлоридної кислоти і кип’ятять на водяній бані протягом 15 хвилин. Друга пробірка є контрольною. Потім в обидві пробірки додають по 2 мл 15 %-го розчину натрій гідроксиду та по 5 крапель розчину купрум(ІІ) сульфату і нагрівають (реакція Троммера). У пробірці, в якій проводився гідроліз крохмалю хлоридною кислотою при нагріванні, спостерігається утворення червоно-коричневого осаду купрум(І) оксиду (позитивна реакція Троммера), а в контрольній пробірці такий осад не утворюється (негативна реакція Троммера).
Дослід 44. Кислотний гідроліз клітковини
Гідроліз клітковини мінеральними кислотами проходить значно повільніше, ніж крохмалю. Якщо клітковину заздалегідь обробити 80 %-им розчином сульфатної кислоти, то процес гідролізу клітковини значно прискорюється.

Глюкозу можна виявити характерними реакціями на моносахариди, наприклад, реакцією Барфеда.
Реакція Барфеда. Гексози в реакції з купрум(ІІ) ацетатом утворюють купрум(І) оксид. Сумарне рівняння для глюкози має такий вигляд:
Ця реакція відбувається у середовищі, яке має значення рН, близьке до нейтрального. В цих умовах відновлюючі дисахариди не окиснюються, що дає змогу відрізнити їх від моносахаридів.
Гідроліз клітковини. Невелику кількість вати (100 – 200 мг) вносять у пробірку, заливають її 3 %-им розчином сульфатної кислоти і кип’ятять протягом 10 хв.
В другу пробірку вносять таку ж кількість вати, обробляють її невеликою кількістю (≈ 0,5 мл) 80 %-го розчину сульфатної кислоти до повного розчинення, потім розбавляють вміст пробірки водою до об’єму 1 мл та кип’ятять на водяній бані протягом 5 хв.
Вміст обох пробірок нейтралізують розчином лугу та проводять реакцію Барфеда (додають по 1 мл розчину Барфеда і після пере-мішування нагрівають до кипіння).
У пробірці, що містила необроблену концентрованою сульфатною кислотою клітковину, осад червоно-коричневого кольору купрум(І) оксиду не утворюється (негативна реакція Барфеда).
У пробірці, що містила оброблену концентрованою сульфатною кислотою клітковину, з’являється осад червоно-коричневого кольору купрум(І) оксиду (позитивна реакція Барфеда).
4.5.1 Лабораторна робота.
Якісний функціональний аналіз вуглеводів
Завдання. Виконати якісні реакції на вуглеводи. Результати дослідів занести до табл. 4.8.

Контрольні запитання
1. Якою реакцією доводять наявність α-глікольного фрагмента у молекулі вуглеводів?
2. За допомогою яких реагентів можна виявити будь-які вуглеводи в досліджуваному зразку? Що при цьому спостерігають?
3. За допомогою яких реагентів можна виявити моносахариди в дослі-джуваному зразку? Що при цьому спостерігають?
4. Якою реакцією можна довести, що сахароза не має відновлювальних властивостей?
5. Чим обумовлена поява коричнево-червоного забарвлення при нагріванні розчину лактози, до якого додали розчин купрум(ІІ) сульфату? Про які властивості лактози це свідчить?
6. Якісною реакцією на який вуглевод є реакція з йодом? Яким візуаль-ним ефектом вона супроводжується?
7. Якою реакцією можна довести, що кінцевим продуктом кислотного гідролізу крохмалю є глюкоза?
8. Якою реакцією можна розрізнити моносахариди і відновлюючі дисахариди?
9. Чи буде лактоза вступати в реакцію Барфеда?
10. Чи з’явиться коричнево-червоне забарвлення при нагріванні зразка клітковини, попередньо не обробленого концентрованою сульфатною кислотою, після додання розчину Барфеда?