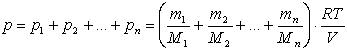

|
2.1.7. Ідеальний газ. Рівняння стану
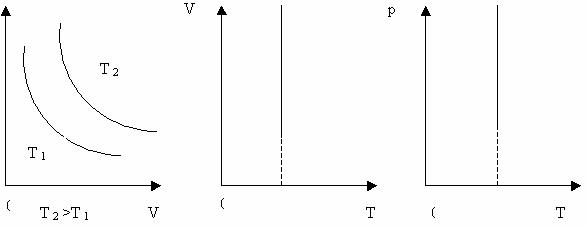
Ізопроцеси. Закон Дальтона Ідеальним називають такий газ, для якого можна знехтувати розмірами молекул та силами молекулярної взаємодії. Молекули в такому газі співударяються за законом співударяння пружних куль. Реальні гази поводять себе як ідеальний тоді, коли середня відстань між молекулами у багато разів перевищує їхні розміри, тобто коли розрідження досить велике. Газ може бути в різних станах, тобто деяка маса газу має об’єм V, тиск p і температуру Т. Величини V, p,Т , що характеризують стан газу, називаються термодинамічними параметрами. Процеси, що відбуваються при сталому значенні одного з параметрів стану ( Т, V або p) з певною сталою масою газу, називаються ізопроцесами. Ізотермічний процес - процес , що відбувається при сталій температурі ( Т= const). За законом Бойля-Маріотта, тиск даної маси газу при сталій температурі обернено пропорційний об’єму газу. Отже,
Криву залежності тиску газу від його об’єму при сталій температурі називають ізотермою. Графік залежності між параметрами газу при Т = const (Рис. 24).
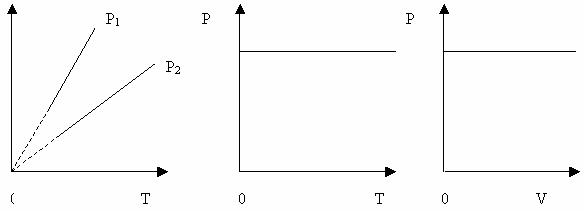
Рисунок 22 Ізобаричний процес – процес, який відбувається при сталому тиску ( р= const). Виходячи із закону Гей-Люссака, відносна зміна об’єму даної маси газу в ізобарному процесі прямо-пропорційна зміні температури t. Отже, V0- об’єм газу при t = 0 оС , V- його об’єм при температурі t, ? – термічний коефіцієнт об’ємного розширення. Для всіх газів: ? = Криву залежності об’єму газу від температури при сталому тиску називають ізобарою. Графік залежності між параметрами при р= const (Рис. 25).
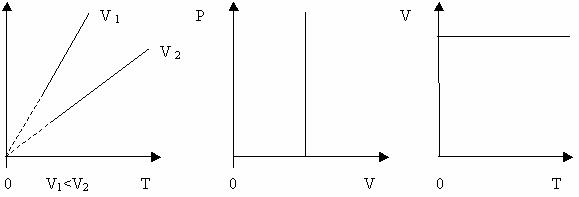
Рисунок 23 Вищому тиску відповідає нижча ізобара. Штрихи означають, що закон Гей-Люссака в області низьких температур не застосовується. Об’єм не може перетворитися в нуль при температурі – 273 0С. Ізохоричний процес – це процес , який відбувається при сталому об’ємі (V = const). Виходячи із закону Шарля, тиск даної маси газу при сталому об’ємі пропорційний його абсолютній температурі: р = р0 ( 1+ jt) р0 - тиск при 0 0С, j – термічний коефіцієнт тиску газу.
Залежність тиску газу від температури при сталому об’ємі графічно зображається прямою, яка називається ізохорою. Меншому об’ємі відповідає ізохора , що лежить вище. Графік залежності між параметрами при сталому об’ємі V = const (Рис. 26). Рисунок 14 Виходячи з закону Шарля, можна знайти температуру, при якій тиск газу буде дорівнювати нулеві. p=p0(1+jt), 0=p0(1+jt) Оскільки p0 ?0, то 1+jt=0 або t=-2730C. Температуру - 273,160С називають абсолютним нулем температур. Англійський вчений У.Томсон запропонував абсолютну шкалу температур. За абсолютний нуль було прийнято температуру t = - 2730C ( точніше t0= - 273,160С) абсолютна температура Т пов’язана з температурою t за шкалою Цельсія таким співвідношенням : Т= t + 2730C В шкалі Цельсія за 00С прийнято температуру танення льоду при нормальному тискові, за 1000 С – температуру кипіння води при нормальному тискові. В шкалі Кельвіна за 0 прийнято температуру , при наближенні до якої швидкість поступального руху молекул ідеального газу прямує до нуля, а 1 кельвін відповідає 1/100 інтервалу температур між температурами танення льоду і кипіння води за нормального тиску. За шкалою Фаренгейта:
Основна одиниця температури в СІ є кельвін – [Т] = К. Змінюючи всі три параметра р, V і Т газу і користуючись газовими законами можна отримати рівняння Клапейрона.
Добуток тиску даної маси газу на об’єм, поділений на абсолютну температуру, є величиною сталою. При t = 00C, р = 1,013 · 105Па один моль будь-якого газу має об’єм V0=22,4?10-3м3. Підставивши ці дані в закон Клапейрона, отримуємо значення константи, яка є однакова для будь-якого 1 моля газу. Її називають молярною універсальною газовою сталою.
A для одного моля газу тепер можна записати: p0V0=RT Цей вираз називають рівнянням Менделєєва – Клапейрона. А для будь-якої маси газу рівняння Менделєєва – Клапейрона матиме вигляд:
Якщо в об’ємі V знаходиться суміш газів, які не реагують один з одним, то використавши рівняння Менделєєва – Клапейрона, визначимо тиск:
де ті, Мі – маса і молярна маса і – го газу. Закон Дж. Дальтона: «Тиск суміші газів дорівнює сумі парціальних тисків газів, з яких складається дана суміш». Парціальним тиском називається тиск, який був би створений за даних умов (Т,V) окремо одним газом з суміші. |