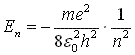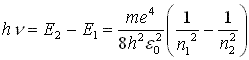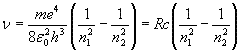Курс загальної фізики для слухачів-іноземців підготовчого
відділення

|
8.
Фізика атома і атомного ядра
8.1.1. Фізика атома
Першу модель атома було запропоновано у 1902 р. У. Кельвіном (У. Томсоном): позитивно заряджена куля, всередині якої знаходяться
нерухомі електрони. Дана модель не пояснювала стійкості атома та спектральні
закономірності випромінювання атомів. Досліджуючи проходження α – частинок з
енергією в декілька МеВ крізь тонкі пластини, зробили висновок про те, що
атом складається з позитивно зарядженого ядра і електронів, які його
оточують. Розмір ядра ≈ 10-14 – 10-15м, розміри атома
≈ 10-10м. (планетарна модель). Модель атома подібна до сонячної
системи, тому її називають планетарною. За законами класичної електродинаміки електрони рухаються по замкненим
орбітам навколо позитивного ядра. Цей рух буде прискорений (доцентрове
прискорення), тому електрони випромінюють електромагнетні хвилі. Енергія
електрона при цьому зменшується і він повинен впасти на ядро. Однак атоми
стійкі і випромінюють несуцільний спектр, а лінійчатий. Отже, планетарна
модель Резерфорда також мала багато протиріч. В 1913 р. Н. Бор розробив
теорію атома водню, яка була підтверджена експериментально. В основі
борівської теорії атома лежать два основні постулати: 1) Електрони можуть рухатись в атомі тільки по певних орбітах,
перебуваючи на яких вони, незважаючи на наявність у них прискорення, не
випромінюють (постулат стаціонарних атомів). 2) Правило квантування орбіти: в стаціонарному стані атома електрони,
рухаючись по колових орбітах, повинні мати дискретні, квантові значення
моменту імпульсу, що відповідає умові: де
m – маса електрона,
V,
r
– швидкість електрона на
n
– й орбіті та її радіус,
h
– стала Планка. 3) Правило частот: атом випромінює або поглинає
квант електромагнітної енергії при переході електрона з одного стаціонарного
стану в інший. Енергія кванта дорівнює різниці енергії стаціонарних
станів електрона до Е2 і після Е1 переходу: Розглянемо найпростіший атом – атом водню. Він
складається з ядра, до складу якого входить протон і електрон, що
обертаються навколо ядра по коловій орбіті. За борівською моделлю ядро атома
нерухоме, тому повна енергія Е атома на
n – й орбіті є сумою
кінетичної енергії Ек і енергії взаємодії електрона з ядром.
На електрон з боку ядра діє кулонівська сила притягання, надаючи йому
доцентрове прискорення. Тому З цих двох рівнянь дістанемо:
а частоти випромінювань:
R – 1,1·107 м-1
– стала Ридберга, с – швидкість світла у вакуумі. Для воднеподібних атомів – одноіонізованого атома гелію
He+
, двоіонізованого атома літію –
Li++
і т.д.: де
z – порядковий номер
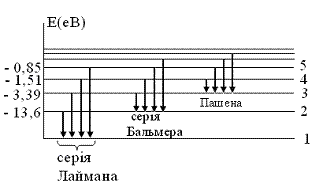
елемента. Спектр енергії водню зображено на (Рис.72):
1)
n1=1,
n2=2, 3, 4, … ,
ультрафіолетові лінії серії Лаймана. 2)
n1=2,
n2=3, 4, 5 … ,
видимі лінії серії Бальмера. 3)
n1=3,
n2=4, 5, 6, …, серії
Пашена (інфрачервоні лінії). Постулати Бора дали можливість пояснити властивості атома водню (його розмір, спектральні лінії, енергію іонізації). Проте теорія Бора не змогла пояснити властивості інших атомів. Для послідовності обґрунтування властивостей атомів та інших об’єктів мікросвіту була створена нова фізична теорія – квантова механіка. |