1 ЗАГАЛЬНІ ВІДОМОСТІ ПРО БУДОВУ РЕЧОВИНИ
1.1 Види зв’язку
В залежності від будови зовнішніх електронних оболонок атомів можуть утворюватися різні види зв’язку.
Ковалентним називається зв’язок атомів один з одним, що досягається за рахунок електронів, які стають загальними, як це схематично показано для двохатомної молекули на рис. 1.1. Ковалентний зв’язок спостерігається в молекулах, утворених металоїдними атомами, наприклад у молекулі хлору та ін.
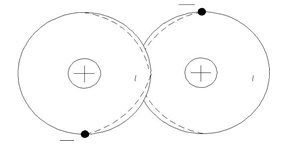
Рисунок 1.1 – Схематичне зображення двохатомної молекули з ковалентним зв’язком
Молекули, у яких центри додатних і від’ємних зарядів збігаються, є нейтральними. Якщо ж в окремих молекулах центри протилежних за знаком зарядів не збігаються і знаходяться на деякій відстані один від одного, то такі молекули називаються полярними або дипольними.
Полярна молекула характеризується величиною дипольного моменту, що визначається добутком заряду і відстані між центрами додатного і від’ємного зарядів.
При розгляді будови полярних і неполярних молекул часто виходять з того, що на ці молекули не діють зовні електричні сили. Але вплив електричних сил може суттєво змінити внутрішню структуру молекул і її властивості.
Зокрема, під дією зовнішнього електричного поля молекули, які самі по собі були неполярними, стають полярними. Якщо неполярну молекулу помістити між пластинами конденсатора, то заряди пластин будуть впливати на розподіл заряду всередині молекули. Додатно заряджені ядра будуть притягуватись до від’ємного заряду пластин, а від’ємно заряджені електрони – до додатних пластин. В результаті відбудеться зміщення електронів відносно ядер. Якщо раніше центри тяжіння додатних і від’ємних зарядів збігались, то під дією електричного поля вони розійдуться, і молекула стане дипольною. Утворені диполі називаються наведеними або індукованими. При знятті зовнішнього електричного поля дипольний момент щезає, молекула знову стає неполярною.
Ковалентний зв’язок може бути як у молекулах (у трьох агрегатних станах речовини), так і між атомами, що утворюють ґратки кристала. Прикладами таких кристалів є алмаз, кремній, германій. Ковалентним зв’язком можуть утримуватися не тільки однакові атоми:

Іонний зв’язок визначається силами притягання між додатними і від’ємними іонами. Тверді тіла іонної структури характеризуються підвищеною механічною міцністю та достатньо високою температурою плавлення. Типовими прикладами іонних кристалів є галоїдні солі лужних металів.
На рис. 1.2 показані структури хлористого натрію і хлористого цезію. З рисунка видно щільне упакування іонів першої речовини і нещільне – другої:
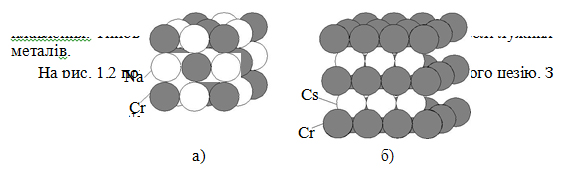
Рисунок 1.2 – Структура і щільне упакування іонів хлористого натрію (а) і структура і нещільне упакування іонів хлористого цезію (б)
Металевий зв’язок веде також до утворення твердих кристалічних тіл. Метали можна розглядати як системи, побудовані з розташованих у вузлах ґраток додатно заряджених атомних остовів, що знаходяться в середовищі вільних електронів (рис. 1.3).
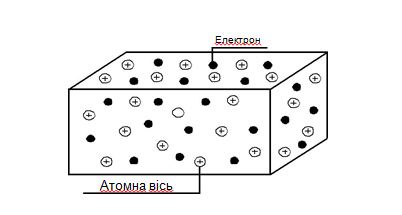
Рисунок 1.3 – Схема будови металевого провідника
Притягання між додатними атомними остовами й електронами є причиною монолітності металу. Наявність вільних електронів веде до високої електропровідності і теплопровідності металу, а також є причиною його блиску. Ковкість металу пояснюється переміщенням і ковзанням окремих шарів атомних остовів.
Молекулярний зв’язок (зв’язок Ван-дер-Ваальса). Такий зв’язок існує в ряді речовин між молекулами з ковалентними внутрішніми молекулярними зв’язками. Міжмолекулярне притягання в цьому випадку обумовлюється погодженим рухом валентних електронів у сусідніх молекулах (рис. 1.4). У будь-який момент часу електрони максимально віддалені один від одного і максимально наближені до додатних зарядів.
При цьому сили притягання валентних електронів додатно заряджених остовів сусідніх молекул виявляються сильніші сил взаємного відштовхування електронів зовнішніх орбіт. Зв’язок Ван-дер-Ваальса спостерігається між молекулами деяких речовин, наприклад парафіну, що має низьку температуру плавлення і свідчить про неміцність його кристалічної молекулярної ґратки.
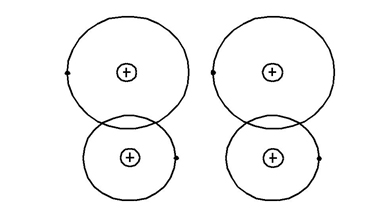
Рисунок 1.4 – Схематичне зображення двох взаємодійних молекул (зв’язок Ван-дер-Ваальса)
1.2 Класифікація речовин за електричними властивостями
Дослідження спектрів випромінювання різних речовин у газоподібному стані, коли атоми розташовані один від другого на великих відстанях, показує, що для атомів кожної речовини характерні цілком визначені спектральні лінії. Це говорить про наявність енергетичних станів (рівнів) для різних атомів.
Частина цих рівнів заповнена електронами в нормальному (незбудженому) стані атома, на інших енергетичних рівнях електрони можуть знаходитися тільки після того, як атом піддасться зовнішньому енергетичному впливові і стане збудженим. Прагнучи перейти до стійкого стану, атом випромінює надлишок енергії в момент повернення електронів на рівні, на яких енергія атома мінімальна (рис. 1.5).
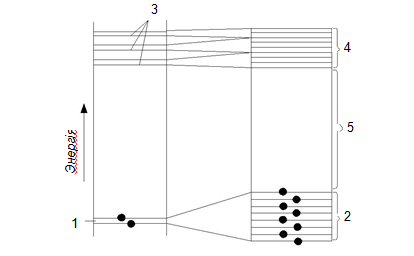
Рисунок 1.5 – Схема розташування енергетичних рівнів відокремленого атома (ліворуч) і неметалевого твердого тіла (праворуч)
(1 – нормальний енергетичний рівень атома, 2 – заповнена електронами зона, 3 – рівні збудженого стану атома, 4 – вільна зона, 5 – заборонена зона)
При переході газоподібної речовини в рідину, а потім при утворенні кристалічних ґраток твердого тіла, всі наявні в даному типі атомів електронні рівні (як заповнені електронами, так і незаповнені) трохи зміщаються внаслідок дії сусідніх атомів один на одного. Таким чином, з окремих енергетичних рівнів відокремлених атомів у твердому тілі утворюється ціла смуга – зона енергетичних рівнів.
На рис. 1.6 показано розходження в енергетичних діаграмах діелектриків, напівпровідників і провідників.

Рисунок 1.6 – Енергетичні діаграми діелектриків (а), напівпровідників (б) і провідників (в) при абсолютному нулі згідно з зонною теорією твердого тіла (1 – заповнена електронами зона, 2 – заборонена зона, 3 – зона вільних енергетичних рівнів)
Діелектриками будуть такі матеріали, у яких заборонена зона настільки велика, що електронної електропровідності в звичайних умовах не спостерігається. Діелектричні матеріали мають надзвичайно велике значення для електротехніки. Вони використовуються в різних електротехнічних пристроях для створення електричної ізоляції, яка оточує струмопровідні частини, відокремлюючи їх одну від одної, що перебувають під дією різних електричних потенціалів, а також в конденсаторах для створення певного значення електричної ємності. Тому діелектрики часто називають електроізоляційними матеріалами. До електроізоляційних матеріалів висуваються різні вимоги. Крім електроізоляційних властивостей велике значення мають механічні, теплові та інші фізико-хімічні властивості. Важливе значення має також вартість і дефіцитність матеріалів.
За агрегатним станом електроізоляційні матеріали діляться на тверді, рідкі й газоподібні.
Напівпровідниками будуть речовини з більш вузькою забороненою зоною, яка може бути подолана за рахунок зовнішніх енергетичних впливів.
При відсутності в напівпровіднику вільних електронів (при нулеві Кельвіна) прикладена до нього різниця електричних потенціалів не викликає струму. Якщо ззовні буде прикладена енергія, достатня для переходу електронів через заборонену зону, то, ставши вільними, електрони зможуть переміщатися і під дією електричного поля, створюючи електронну електропровідність напівпровідника.
У заповненій зоні, звідкіля пішов електрон, утворилася «електронна дірка», а тому в напівпровіднику почнеться інший, «естафетний», рух електронів, які заповнюють дірку, причому під впливом електричного поля дірка буде рухатися в напрямку поля, як еквівалентний додатний заряд.
Процес переходу електронів у вільний стан супроводжується і зворотним явищем, тобто поверненням електронів у нормальний стан. У результаті в речовині настає рівновага, тобто кількість електронів, що переходять у вільну зону, стає рівною кількості електронів, що повертаються назад у заповнену зону.
З підвищенням температури число вільних електронів у напівпровіднику зростає, а зі зниженням температури до абсолютного нуля – убуває аж до нуля. Таким чином, електропровідність речовин при різних температурах може бути істотно різна.
Енергію, необхідну для переходу електрона у вільний стан або для утворення дірки, може давати не лише тепловий рух, але й інші джерела енергії, наприклад світло, потік електронів і ядерних частинок, електричні і магнітні поля, механічні впливи та інші.
Електричні властивості визначаються умовами взаємодії атомів речовини і не є неодмінною особливістю даного атома. Наприклад, вуглець у вигляді алмазу є діелектриком, а у вигляді графіту має велику провідність.
Домішки і дефекти кристалічних ґраток сильно впливають на електричні властивості твердих тіл.
До напівпровідників належать такі основні матеріали: кремній, германій, селен, телур, сірка та інші. В практичному застосуванні поділяються на прості напівпровідники, напівпровідникові хімічні з’єднання та напівпровідникові комплекси.
Провідниками будуть матеріали, у яких заповнена електронами зона впритул прилягає до зони вільних енергетичних рівнів або навіть перекривається нею. Внаслідок цього електрони в металі можуть переходити з рівнів заповненої зони на незайняті рівні вільної зони навіть під впливом слабких напруженостей прикладеного до провідника електричного поля.
До провідникових матеріалів відносять матеріали високої провідності, з яких виготовляють струмопровідні частини електричних машин і апаратів, обмотки, контакти, проводи і кабелі та сплави високого опору для виготовлення резисторів, електронагрівальних пристроїв, реостатів, термопар тощо.
1.3 Класифікація речовин за магнітними властивостями
За магнітними властивостями матеріали поділяються на слабомагнітні і сильномагнітні. До перших належать діамагнетики і парамагнетики, до других – магнітні матеріали, що знайшли найбільше застосування в техніці в залежності від особливостей їхніх магнітних властивостей.
Діамагнетики –це речовини з магнітною проникністю m < 1, значення якої не залежить від напруженості зовнішнього магнітного поля. До них відносять водень, інертні гази, більшість органічних сполук, кам’яну сіль і ряд металів: мідь, цинк, срібло, золото, ртуть, а також вісмут, галій, сурму.
Парамагнетики – це речовини з магнітною проникністю m > 1, яка також не залежить від напруженості зовнішнього магнітного поля. У їхнє число входять кисень, оксид азоту, солі заліза, кобальту, нікелю, лужні метали, алюміній, платина.
Діамагнетики і парамагнетики за магнітними властивостями знайшли обмежене застосування в техніці.
Магнітні матеріали – матеріали, у яких m >> 1 і залежить від напруженості магнітного поля. До них відносять залізо, нікель, кобальт і їхні сплави, сплави хрому і марганцю, гадоліній, ферити, різні сполуки. Магнітні матеріали застосовуються для виготовлення осердь трансформаторів, магнітних систем електричних машин, в апаратах, приладах тощо. Стосовно електричного струму більшість магнітних матеріалів є провідниками. Основу магнітних матеріалів складає залізо і його сплави.
При виготовленні ЕТМ використовуються різні методи хімічного синтезу, штучне вирощування монокристалів; нанесення тонких плівок на відповідні підкладки; різні способи особливо глибокого очищення (технологія зонного плавлення; плавлення та розпил у вакуумі й інші) або введення домішок; іонно-плазмова обробка; дія на ЕТМ електромагнітного поля та проникливих випромінювань тощо.
1.4 Контрольні питання
- Охарактеризуйте роль ЕТМ для забезпечення надійної роботи електроустановок.
- Види зв’язку та їх характеристика.
- Ковалентний зв’язок, полярні та неполярні молекули.
- Іонний зв’язок.
- Металевий зв’язок.
- Молекулярний зв’язок.
- Характеристика провідників.
- Характеристика напівпровідників.
- Характеристика діелектриків.
- Характеристика магнітних провідників.
- Вплив зовнішнього середовища на роботу ЕТМ.