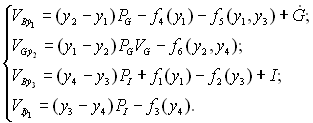| |
|
Автори:
Злепко С. М., Коваль Л. Г., Гаврілова Н. М., Тимчик І. С. |
|
Навчальний посібник |
6.2 Математичні моделі процесу зміни глікеміїСпецифіка керування глікемією за допомогою терапевтичного автомата «Штучна Як математичний імітатор МІ (МS) процесу зміни глікемії може бути використана нелінійна математична модель, запропонована В.Больє. У цій математичній моделі передбачається, що всі процеси протікають у двох компартментах (об?ємах організму, що відрізняються своєю специфікою і взаємодіють між собою) – судинному і позасудинному. Як вихідні змінні у нелінійній моделі прийнята глікемія у1 і позасудинна концентрація глюкози у2, концентрація інсуліну в крові (інсулінемія) у3 і позасудинна інсулінемія у4. Як вхідні змінні прийнята швидкість ? інфузії екзогенного інсуліну і швидкість ? надходження екзогенної глюкози в кров. Швидкість VВу1 зміни змісту глюкози визначається функцією ?, швидкістю (у2 - у1)РG надходження глюкози з позасудинної рідини, швидкістю f4(y1) виділення глюкози нирками і швидкістю f5(y1, у3) накопичення глюкози в печінці. Тут параметр VВ – об'єм крові, параметр РG - транскапілярна проникність глюкози. Швидкість VGу2 зміни глюкози в позасудинній рідині визначається швидкістю (у1 - у2)PGVG надходження глюкози з крові і швидкістю f6(y2, у4) утилізації глюкози тканинами. Тут параметр VG – позасудинний глюкозний об'єм. Швидкість VВу3 зміни інсуліну в крові визначається функцією ?, швидкістю (у4 - у3)РІ надходження інсуліну з позасудинної рідини, швидкістю f1(y1) секреції інсуліну бета-клітинами і швидкістю f2(y3) інактивації інсуліну в крові. Тут параметр РІ – транскапілярна проникність інсуліну. Швидкість VІу4 зміни інсуліну в позасудинній рідині визначається швидкістю (у3 - у4)РІ надходження інсуліну з крові і швидкістю f3(y4) інактивації інсуліну у позасудинній рідині. Тут параметр VІ – позасудинний інсуліновий об'єм. Зміна стану, що розглядається, з часом описується математичною моделлю у вигляді системи диференціальних рівнянь
Для параметрів процесу наводяться такі значення: 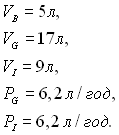 Розмірність концентрації глюкози прийнята в г/л, а концентрація інсуліну – в ЕД/л. Тенденції в області розробки математичних моделей процесу зміни глікемії полягають у тому, що ці моделі розвиваються в напрямку відображення процесів усіх найважливіших показників метаболізму, основних гормонів і нелінійних ефектів їхньої взаємодії. Необхідно удосконалювати процедури ідентифікації параметрів математичних моделей за мінімальним числом клінічних даних і розробляти математичні індекси для кількісної оцінки важкості патологічних процесів метаболізму. Модуль моніторингу глікемії виконує функцію неперервного і тривалого визначення поточної глікемії. На підставі інформації про глікемію в модулі алгоритму керування формується сигнал на інфузію інсуліну з умови забезпечення необхідних характеристик перехідних процесів. Модуль інфузії призначений для введення необхідної кількості інсуліну в організм пацієнта. Визначення результатів дії інсуліну на глікемію за допомогою модуля моніторингу замикає контур зворотного зв'язку. Крім основних функціональних модулів, терапевтичний автомат оснащується пристроями реєстрації, відображення і збереження інформації про розрахункові і фактичні значення глікемії, швидкості інфузії інсуліну й інших препаратів, їхніх сумарних величин і поточний час. Модуль моніторингу глікемії реалізується у вигляді глюкозного сенсора, що перетворює вимірювану величину, пов'язану з глікемією, в електричний сигнал. Цей сигнал піддається необхідному підсиленню і перетворенню. Для доставки крові до сенсора використовується, у разі потреби, кровозабірна магістраль із пластикової трубки і катетера та спеціальний насос. Модуль керування глікемією реалізується на стандартних засобах обчислювальної техніки, що включають центральний процесор, оперативну і зовнішню пам'ять, інтерфейс. Модуль інфузії інсуліну реалізується у вигляді спеціального керованого насоса і інсулінонагнітальної магістралі з пластикової трубки, перехідника і канюлі. До перехідника приєднується магістраль для нагнітання фізіологічного розчину з мінімальною постійною швидкістю з метою кращого вимивання гормону в кровотік без істотної затримки. Найбільш відомий апарат за назвою «Біостатор» чи під абревіатурою GCIIS (Glucose Controlled Insulin Infusion System). Основою модуля моніторингу глікемії є глюкозний сенсор, що визначає глікемію в цілісній крові за проточним методом. Принцип дії сенсора базується на електрохімічному визначенні перекису водню, який утворюється при каталітичному окислюванні глюкози крові розчинним киснем. Як спеціальний каталізатор застосовується фермент глюкозооксидаза, іммобілізований на напівпроникній мембрані. Час затримки між моментом забору крові і моментом визначення глікемії – не більше 90 с. Робочий діапазон сенсора 0-1000 мг/под. Втрата крові - 50 мл за добу. Термін роботи мембрани – дві доби. У модулі керування глікемією реалізований алгоритм «Біостатор-ІІ». Дослідження функціонування терапевтичного автомата «Біостатор» ТАБ (ТАB) при тривалій терапії було проведено датськими фахівцями. Було встановлено, що з часом характеристики глюкозного сенсора знижуються, і тому рекомендовано проводити його калібрування за допомогою автономної апаратури через кожні три години роботи. Для зручності виконання цієї операції запропоновано сконструювати в автоматі пристрій для забору разових проб крові. Було перевірено вплив параметрів алгоритму «Біостатор-ІІ» на швидкість інфузії інсуліну. Варіювалися коефіцієнт пропорційності у виразі для диференціального фактора і коефіцієнт, що визначає нахил керувальної функції при незмінних інших параметрах. Зроблений висновок, що зменшення варійовних параметрів нижче певних величин призводить до зростання потреби пацієнтів в інсуліні. Експерименти з використанням автомата «Біостатор» виявилися діючим засобом для визначення добової дози інсуліну, необхідної діабетичним пацієнтам У 1983 р. японськими дослідниками створений експериментальний автомат «Штучна бета-клітина» переносного виконання. Габарити автомата 18ґ17,7ґ7,9 см, маса - 700 г. Мініатюризація автомата була забезпечена за рахунок оригінальної конструкції глюкозного сенсора в модулі моніторингу глікемії. Сенсор виконаний у формі голки діаметром 0,4-1мм і призначений для введення в м'язову чи підшкірну тканину пацієнта. Конструктивно сенсор складається з двох електродів. Катод з нержавіючої сталі, покритої сріблом, виконаний у вигляді трубочки довжиною 2 см і діаметром 0,4-1 мм, у яку вставлений платиновий анод у вигляді дротика з кулькою діаметром 0,3-0,7 мм на кінці. Сам дротик розміщається в тонкій скляній трубці. Кінець анода покритий глюкозооксидазою і захищений плівкою з поліуретану. Автомат містить підсилювач струм-напруга, аналого-цифровий перетворювач, комп'ютер, п?ятиміліметровий шприц для інфузії інсуліну з електромеханізмом подачі і батарейку електроживлення. У модулі керування глікемією реалізований алгоритм «Осака». Цими ж дослідниками в 1984 р. створений експериментальний автомат «Штучна бета-клітина» переносного виконання, з габаритами 12ґ15ґ6 см, масою 400 г. Конструкція принципово аналогічна попередньому варіанту. Повідомляється, що при одноразовій заміні голкового глюкозного сенсора автомат, що переноситься, забезпечує керування глікемією в амбулаторних пацієнтів-діабетиків протягом 7 діб. Таким чином, сучасний стан в області розробок терапевтичних автоматів «Штучна бета-клітина» характеризується створенням декількох експериментальних терапевтичних автоматів «Штучна бета-клітина», а також комерційного автомата за назвою «Біостатор» (фірма «Майлз», США). Конструктивне виконання автоматів є стаціонарним, і тому фізична активність і можливості пересування пацієнта поки обмежені. Результати клінічного застосування автомата «Біостатор» у багатьох країнах свідчать про значний терапевтичний ефект, принципово недосяжний традиційними методами інсулінотерапії. Потрібно відзначити зворотний ефект, коли за допомогою досліджень на терапевтичному автоматі «Штучна бета-клітина» розроблялися рекомендації з удосконалення традиційних методів інсулінотерапії. Аналіз досліджень в області створення терапевтичних автоматів «Штучна бета-клітина» дозволяє вважати, що в майбутньому конструктивне виконання зробить автомат «Штучна бета-клітина» переносним за рахунок застосування мініатюрних голчастих глюкозних сенсорів і малогабаритних технічних засобів інформатики. Одержання інформації про поточну глікемію буде відбуватися практично без запізнювання і добору крові.
|