
2 СТРУКТУРА І ФІЗИКО-МЕХАНІЧНІ ВЛАСТИВОСТІ ТВЕРДИХ ТІЛ
2.1 Кристалізація і склування
При достатньому зближенні частинок між ними виникають сили взаємодії ( forces interworking). Незалежно від природи цих сил, загальний характер їх залишається однаковим (рис. 2.1,а): на відносно великих відстанях виникають сили тяжіння ( forces interworking) Fпр, що збільшуються із зменшенням відстані між частинками r (крива 1); на невеликих відстанях виникають сили відштовхування Fвід, які із зменшенням r збільшуються значно швидше, ніж Fпр (крива 2). Так, для іонних кристалів Fпр ~1/ r2, а Fвід ~1/ r 9.
На відстані r=r![]() сили відштовхування врівноважують сили тяжіння і результуюча сила F звертається в нуль (крива 3). Оскільки F=U/r, де U – енергія взаємодії частинок, то при r=r0 величина U досягає мінімального значення, рівного – Uсв (рис. 2.1, б). Тому стан частинок, що зближують на відстань r0, є станом стійкої рівноваги, внаслідок чого під впливом сил взаємодії частинки повинні б розташовуватися в строгому порядку на відстані r0 один від одного, утворюючи тіло з правильною внутрішньою структурою.
сили відштовхування врівноважують сили тяжіння і результуюча сила F звертається в нуль (крива 3). Оскільки F=U/r, де U – енергія взаємодії частинок, то при r=r0 величина U досягає мінімального значення, рівного – Uсв (рис. 2.1, б). Тому стан частинок, що зближують на відстань r0, є станом стійкої рівноваги, внаслідок чого під впливом сил взаємодії частинки повинні б розташовуватися в строгому порядку на відстані r0 один від одного, утворюючи тіло з правильною внутрішньою структурою.
Проте крім потенційної енергії (potential energy) взаємодії частинки мають кінетичну енергію (kinetic energy) теплового руху, намагаючись зруйнувати порядок в їх розташуванні. Стан і властивості речовини визначаються відносною роллю цих двох чинників. В газоподібному стані відстані між частинками такі великі, що сили взаємодії між ними практично не виявляються. Тому в проміжках між зіткненнями, що носять випадковий характер, частинки поводяться фактично як вільні, створюючи хаотичний поступальний рух. Фіксованих положень рівноваги вони не мають.
У рідинах, густина яких приблизно на три порядки вища густини їх насиченої пари, відстані між молекулами r зменшуються, а сили взаємодії збільшуються настільки, що молекули не можуть вільно переміщатися в просторі: кожна молекула виявляється мовби укладеною в комірку, створену сусідніми молекулами, в якій вона створює безладні коливання біля тимчасових положень рівноваги (рис. 2.2, а). Позначимо період цих коливань
τ0, а висоту потенційного бар'єра, який створює для даної молекули її оточення, U. Вірогідність того, що ця молекула набуває енергії теплового руху, достатньої для подолання потенційного бар'єра і переходу в нове положення рівноваги, рівна ехр (![]() ), де К – постійна Больцмана; Т – абсолютна температура. За одиницю часу молекула, що коливається, «підходить» до бар'єра V0 = 1/τ0 раз. Помножуючи це число на вірогідність ехр(
), де К – постійна Больцмана; Т – абсолютна температура. За одиницю часу молекула, що коливається, «підходить» до бар'єра V0 = 1/τ0 раз. Помножуючи це число на вірогідність ехр(![]() ), одержуємо середнє число переходів молекули з одних положень рівноваги за інші за одиницю часу;
), одержуємо середнє число переходів молекули з одних положень рівноваги за інші за одиницю часу; ![]() ехр(
ехр(![]() ). Величина
τ, зворотна
ν, виражає середній час «осілого життя» молекули, яке вона проводить, коливаючись біля даного положення рівноваги:
). Величина
τ, зворотна
ν, виражає середній час «осілого життя» молекули, яке вона проводить, коливаючись біля даного положення рівноваги:
t=t0 exp(U/KT). (2.1)
Для простих рідин, таких, наприклад, як розплавлені метали, t ![]() 10-10 с; t0
10-10 с; t0 ![]() 10-10 с. Отже, біля кожного положення рівноваги молекула робить приблизно 103 коливань потім переходить в нове положення рівноваги і т.д.
10-10 с. Отже, біля кожного положення рівноваги молекула робить приблизно 103 коливань потім переходить в нове положення рівноваги і т.д.
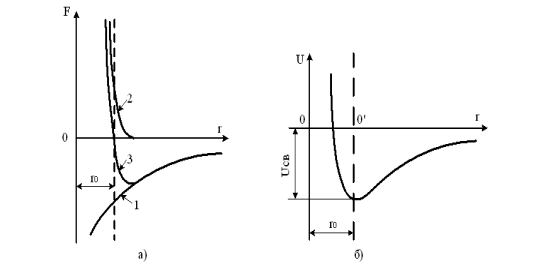
Рисунок 2.1 – Залежність сили взаємодії (а) і потенціальної енергії взаємодії атомів (б) від відстані між ними
Подібних переходів вона робить 1010 за секунду, що приводить до інтенсивного руху її по всьому об'єму рідини. Цей рух і обумовлює основну властивість рідини – текучість, за кількісну міру якої приймають в'язкість h. Наведені міркування показують, що в'язке протікання рідин є типовим активаційним процесом, що протікає з енергією активації U. Звичайно цю енергію ( energy) відносять до моля речовини і вираз (2.1) записують так:
![]() , (2.2)
, (2.2)
де Ua– енергія активації; R – універсальна газова стала.
При зниженні температури і переході речовини в твердий стан відстані між молекулами ще дещо зменшуються і енергетично вигідною стає перебудова частинок з утворенням правильної структури, в якій кожна з частинок виявляється укладеною в комірку постійних розмірів і постійного розташування (рис. 2.2, б). Оскільки така структура є щільнішою, то потенціальний бар'єр, що оточує частинку, підвищується в порівнянні з рідким станом. Разом зі зниженням температури це призводить до того, що частота переходу частинок з комірки в комірку різко зменшується. Частинки фактично закріплюються в певних положеннях рівноваги, роблячи біля них коливання з частотою ![]() , і лише час від часу (приблизно раз протягом декількох діб) можуть переходити з однієї комірки в іншу.
, і лише час від часу (приблизно раз протягом декількох діб) можуть переходити з однієї комірки в іншу.
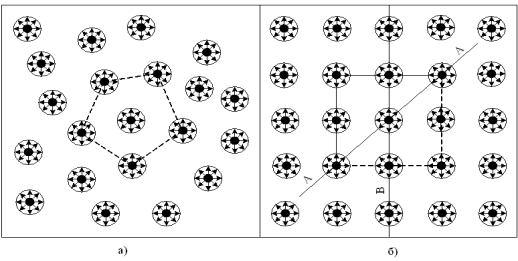
Рисунок 2.2 – Розташування частинок в рідинах (а) і твердих кристалічних тілах (б)
Із структурної точки зору ці три стани речовини розрізняються порядком розташування частинок одна відносно одної – своєю внутрішньою структурою (structure).
Твердому кристалічному стану властива наявність так званого далекого порядку, тобто строгої повторюваності в будь-яких напрямах, наприклад, АА, ВВ і т. д., одного і того ж елементу структури – атома, групи атомів або молекул (рис. 2.2, б). Геометрично така строга періодичність описується завданням кристалічних граток. У фізичних відношеннях тіла з подібною структурою в загальному випадку анізотропи ( anisotropy) – їх властивості залежать від напряму в гратках.
Для рідкого стану характерна відсутність далекого порядку, але наявність так званого близького порядку – певної взаємної упорядкованості в розташуванні елементів структури (рис. 2.2, а). Проте ця впорядкованість порівняно швидко втрачається і вже на відстані, порівняній з розмірами структурних елементів, зникає майже повністю.
У газоподібному стані відсутній як далекий, так і близький порядок.
Близький порядок, властивий рідкому стану, не є стабільним: впорядковані групи молекул безперервно руйнуються тепловим рухом, створюються знову і т. д. Тому для кожної температури можна говорити лише про деякий усереднений близький порядок і деяку усереднену рівноважну структуру рідини з властивою їй енергією активації процесу руху молекул, що обумовлює в'язкість. При зміні температури відбувається перегруповування молекул і встановлення нового рівноважного стану. Подібний процес встановлення в системі рівноваги називається релаксацією (relaxation), а час, протягом якого рівновага встановлюється, називається часом релаксації
τ. За порядком величини він дорівнює часу «осілого життя» молекул, визначуваному співвідношенням (2.2); З цього співвідношення видно, що із зменшенням енергії активації ![]() і підвищенням температури Т час встановлення рівноважної структури рідини різко зменшується. У низькомолекулярних простих рідинах
τ настільки мале (10-10с), що встановлення рівноваги в них протікає практично миттєво. Зі зниженням температури час релаксації збільшується, проте, аж до температури кристалізації (плавлення) він залишається ще настільки малим, що не тормозить процес перегруповування частинок і створення з них енергетично вигідної при цій температурі просторово впорядкованої структури – кристала. Тому процес кристалізації таких рідин протікає практично стрибкоподібно (крива 1 на рис. 2.3) і одержати їх в переохолодженому стані надзвичайно важко.
і підвищенням температури Т час встановлення рівноважної структури рідини різко зменшується. У низькомолекулярних простих рідинах
τ настільки мале (10-10с), що встановлення рівноваги в них протікає практично миттєво. Зі зниженням температури час релаксації збільшується, проте, аж до температури кристалізації (плавлення) він залишається ще настільки малим, що не тормозить процес перегруповування частинок і створення з них енергетично вигідної при цій температурі просторово впорядкованої структури – кристала. Тому процес кристалізації таких рідин протікає практично стрибкоподібно (крива 1 на рис. 2.3) і одержати їх в переохолодженому стані надзвичайно важко.
Інакше кажучи, з розплавами високомолекулярних неорганічних і органічних сполук типу скла і полімерів (polymer), між великими молекулами таких сполук через їх взаємне переплетення вже в рідкому стані встановлюється, як правило, сильна взаємодія. Це обумовлює високу енергію активації ![]() і, отже, високу в'язкість
і, отже, високу в'язкість ![]() і великий час релаксації
τ таких розплавів. Так, поблизу точки плавлення в'язкість заліза приблизно дорівнює 740-3 Па
і великий час релаксації
τ таких розплавів. Так, поблизу точки плавлення в'язкість заліза приблизно дорівнює 740-3 Па![]() с, а в'язкість кварцу 106 Па
с, а в'язкість кварцу 106 Па![]() с. Тому при охолоджуванні розплавів високомолекулярних сполук в'язкість і час релаксації збільшуються настільки, що практично запобігають можливості перебудови елементів структури в упорядкованому стані за певний час. Тому розплав, майже не змінюючи своєї внутрішньої структури, переходить в твердоподібне або, як прийнято говорити, склоподібний стан (glassy condition).
с. Тому при охолоджуванні розплавів високомолекулярних сполук в'язкість і час релаксації збільшуються настільки, що практично запобігають можливості перебудови елементів структури в упорядкованому стані за певний час. Тому розплав, майже не змінюючи своєї внутрішньої структури, переходить в твердоподібне або, як прийнято говорити, склоподібний стан (glassy condition).

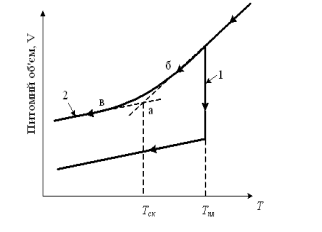
Рисунок 2.3 – Зміна питомого об’єму у процесі кристалізації (1) і склування (2)
Такий процес називають - склування. На відміну від кристалізації він відбувається не при строгій певній температурі – температура плавлення Тпл, а в інтервалі температур (див. рис. 2.3 крива 2). За температуру склування Тск приймають температуру, яка відповідає точці а перетини ділянок бівна кривій 2.