3 МЕТОДИ ВИЛУЧЕННЯ ТА ОЧИЩЕННЯ
ОРГАНІЧНИХ РЕЧОВИН
2.1 Загальні методи роботи.
Посуд, який використовується в лабораторії органічної хімії
Метою органічного синтезу є одержання чистої речовини. Однак органічні реакції часто супроводжуються побічними процесами, тому реакційні суміші містять залишки вихідних речовин та продуктів прямих і побічних реакцій. Це положення ще більшою мірою стосується виділення цінних речовин із вторинної промислової сировини (відходів промислових підприємств) з метою їх подальшого використання.
Знання загальних методів виділення та очищення органічних сполук є необхідною умовою при виконанні лабораторних робіт. Продукти органічного синтезу виділяють із розчинів, суспензій (suspension) та твердих сумішей. Методи виділення та очищення залежать від фізичних та хімічних властивостей органічних речовин. Найбільш поширеними у лабораторній практиці є методи перекристалізації твердих речовин, очищення органічних речовин простою перегонкою та перегонкою з водяною парою, екстракція та інші, що у випадку реагентного оброблення вторинної промислової сировини повинні бути простими як з точки зору хімії, так і в апара-турному (технологічному) відношенні.
3.1 Очищення твердої речовини методом перекристалізації
Перекристалізацію застосовують для очищення твердих речовин. У порівнянні з іншими методами вона найбільш універсальна, відносно мало трудомістка, при правильному проведенні забезпечує високий ступінь очищення. Проте інколи при перекристалізації можливі значні втрати речовини. Цей метод ґрунтується на різниці у розчинності речовини, яку очищають, у певному розчиннику за різних температур: без нагрівання та при нагріванні до температури кипіння розчинника.
Для проведення перекристалізації використовують спеціальний хімічний посуд та лабораторне обладнання. Процес перекристалізації здійснють у кілька стадій:
- - вибір розчинника;
- - приготування насиченого гарячого розчину;
- - "гаряче" фільтрування;
- - охолодження розчину;
- - відділення кристалів, що утворилися;
- - промивання кристалів чистим розчинником;
- - висушування.
Вибір розчинника
Правильний вибір розчинника – основна умова при проведенні перекристалізації. До розчинника висувають ряд вимог:
- - значна різниця між розчинністю речовини у певному розчиннику за кімнатної температури та при нагріванні;
- - розчинник повинен розчиняти при нагріванні лише речовину і не розчиняти домішки. Ефективність перекристалізації зростає при збільшенні різниці у розчинності речовини та домішок;
- - розчинник повинен бути індиферентним як до речовини, так і до домішок;
- - температура кипіння розчинника повинна бути нижчою за температуру плавлення речовини на 10 – 15 °С, інакше при охолодженні розчину речовина виділиться не у кристалічній формі, а у вигляді масла.
Експериментально розчинник вибирають так: невелику пробу речовини вміщують у пробірку, додаючи до неї кілька крапель розчинника. Якщо речовина розчиняється без нагрівання, такий розчинник не придатний для перекристалізації. Вибір розчинника вважається правильним, якщо речовина погано розчиняється в ньому без нагрівання, добре – при кипінні, а при охолодженні гарячого розчину відбувається її кристалізація.
Як розчинник при перекристалізації використовують воду, спирти, бензол, толуол, ацетон, хлороформ та інші органічні розчинники або їх суміші.
Приготування насиченого гарячого розчину
Складають установку для приготування насиченого розчину речовини в певному розчиннику (рис. 3.1).
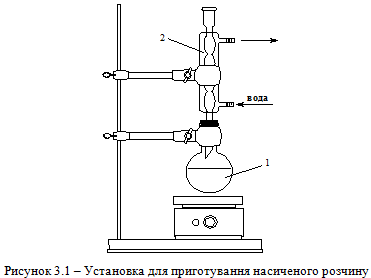
Речовину для перекристалізації та 2 – 3 кип'ятильні камінці вміщу-ють у колбу (1), додають невелику порцію розчинника і нагрівають із зворотним холодильником (2) до кипіння розчину. Якщо початкової кількості розчинника не вистачає для повного розчинення речовини, розчинник невеликими порціями додають за допомогою лійки через зворотний холодильник.
Ефективне очищення сильно забруднених речовин можливе за допомогою різних адсорбентів (активоване вугілля (activeated carbon), силікагель тощо). У цьому випадку готують гарячий насичений розчин речовини, охолоджують його до 40 – 50 °С, додають адсорбент (0,5 – 2 % від маси речовини) і знову кип'ятять із зворотним холодильником протягом кількох хвилин.
"Гаряче" фільтрування
Для відокремлення від механічних домішок та адсорбенту гарячий розчин фільтрують. Щоб запобігти виділенню речовини на фільтрі застосо-вують різні методи. Проста установка для "гарячого" фільтрування (рис. 3.2) складається з спеціальної лійки для "гарячого" фільтрування (1), що обігрівається парою та хімічної лійки (2) із складчастим фільтром (3), який вміщується в неї.

Гарячий насичений розчин речовини швидко виливають на паперовий фільтр, що вміщений у скляну лійку, яка нагрівається з допомогою лійки для гарячого фільтрування. Фільтрат збирають у стакан або конічну колбу. При утворенні на фільтрі кристалів речовини їх промивають невеликою кількістю гарячого розчинника.
Охолодження розчину
При охолодженні фільтрату до кімнатної температури починається процес кристалізації. Для її прискорення фільтрат охолоджують під струменем холодної води. При цьому розчинність речовини зменшується, відбувається остаточна кристалізація.
Відділення кристалів, що утворилися
Відділення кристалів від розчинника здійснюють за допомогою фі-льтрування, при цьому відсмоктування або створення вакууму в приймачі часто використовують для прискорення процесу фільтрування. Для цього використовують вакуумний насос (водоструминний, масляний або Камовського). Фільтрування здійснюють на установці (рис. 3.3), яка складається з лійки Бюхнера (1) з паперовим фільтром, колби Бунзена або спеціальної пробірки (2), проміжної склянки (3) та вакуумного насоса. Розмір паперового фільтра повинен точно збігатися з площею дна лійки Бюхнера.

Паперовий фільтр змочують розчинником, вкладають у лійку і вмикають вакуумний насос. При роботі насоса під фільтром створюється знижений тиск – виникає характерний звук, що свідчить про наявність вакууму в системі і можливість фільтрування. Охолоджений кристалічний продукт разом з розчинником при збовтуванні невеликими порціями переносять з конічної колби на паперовий фільтр.
В процесі фільтрування розчинник проходить через фільтр, осад залишається на ньому. Слід пильнувати, щоб фільтрат не заповнив колбу до рівня тубуса, з'єднаного із проміжною склянкою. Фільтрування продовжують доти, доки не перестане капати фільтрат. Після цього осад віджимають на фільтрі широкою скляною пробкою або спеціальною скляною паличкою, вимикають насос, промивають осад чистим розчинником, вмикають насос і знову віджимають. Установку від’єднують від вакууму, виймають лійку. Фільтр разом з речовиною акуратно переносять в чашку Петрі або спеціальну ємність для висушування.
Висушування твердої речовини
Сушити тверду речовину можна на повітрі при кімнатній температурі. Гігроскопічні речовини висушують в ексикаторах; стійкі до дії повітря та температури – в сушильній шафі, де температура має бути на 20 – 50 °С нижчою за температуру плавлення даної речовини. Для перекристалізованого і висушеного продукту визначають масу, вихід та температуру плавлення.
Визначення температури плавлення
Температурою плавлення речовини вважають температурний інтервал від початку до повного розплавлення цієї речовини. Чим чистіша речовина, тим менший цей інтервал. Різниця між температурою, при якій починається утворення рідкої фази і температурою повного розплавлення для чистих сполук, не перевищує 0,5 °С.
Наявність незначної кількості домішок у речовині знижує її температуру плавлення та відповідно збільшує інтервал плавлення. Цю властивість використують для встановлення ідентичності двох речовин, якщо одна з них відома: ретельно змішують однакові кількості речовин і визначають температуру плавлення суміші (змішана проба). Якщо температура плавлення змішаної проби така ж, як і в чистої речовини, роблять висновок про ідентичність обох речовин.
Температуру плавлення кристалічної органічної речовини визначають у капілярі за допомогою спеціального приладу, зобра-женого нарис. 3.4. Капіляр витягують із скляної трубки, нагріваючи її на полум'ї пальника. Один кінець капіляра запаюють.
Перекристалізовану речовину ретельно розтирають на годинниковому склі або в ступці. Відкритим кінцем капіляра набирають невеличку кількість речовини і кидають його запаяним кінцем донизу в скляну трубку довжиною ≈ 60 – 80 см, поставлену вертикально на лабораторний стіл. Операцію наповнення капіляра повторюють кілька разів, доки в ньому не утвориться цільний стовпчик речовини висотою 2 – 3 мм.

Наповнений капіляр (1) закріплюють гумовими кільцями (2) на термометрі (3) так, щоб проба речовини перебувала на рівні кульки термометра. Нагрівання приладу регулюють так, щоб температура збільшувалася із швидкістю 1°С за хвилину. При цьому уважно стежать за станом стовпчика речовини у капілярі, зазначаючи всі зміни – зміну забарвлення, розкладання, спікання, намокання тощо. Початком плавлення вважають виникнення першої краплі в капілярі (Т1), а закінченням – закінчення розплавлення останніх кристаликів речовини (Т2). Інтервал температур (Т2 – Т1) називають температурою плавлення даної речовини (Тпл).
3.1.1 Лабораторна робота.
Перекристалізація твердої речовини
Використовуючи теоретичні знання підрозділу 3.1, скласти установки, зображені на рис. 3.1 – 3.3, та провести очищення твердої речовини методом перекристалізації. Визначити температуру плавлення очищеної речовини, використовуючи прилад, зображений на рисунку 3.4. Тверді речовини для очищення видаються викладачем. Результати досліду занести до табл. 3.1.

Контрольні запитання
1. На чому ґрунтується принцип очищення речовин перекриста-лізацією? Назвіть основні стадії процесу перекристалізації.
2. Які вимоги висувають до розчинника при перекристалізації речовин різного походження (органічні полярні і неполярні речовини, солі кар-бонових кислот, неорганічні речовини)?
3. Які розчинники використовують при перекристалізації? Як вибира-ють розчинник?
4. Як готують насичений розчин речовини для її перекристалізації?
5. Як відокремлюють насичений розчин від механічних домішок?
6. Як відокремлюють кристалічний продукт від розчину?
7. Як готують лабораторний нутч-фільтр для роботи (створюють вакуум у системі)?
8. Як готують зразки речовини для визначення температури пла-влення?
9. Як визначають температуру плавлення речовини?
10. Які висновки можна зробити про ступінь чистоти продукту за ре-зультатами визначення температури плавлення?
3.2 Очищення органічної речовини перегонкою з водяною парою
Перегонка з водяною парою застосовується для виділення і очищення нерозчинних і малорозчинних у воді висококиплячих речовин, які розкладаються при перегонці при атмосферному тиску. Це найефективніший метод очищення таких речовин від смолистих домішок, а також розділення природних масел і смол на фракції. Перегонку з парою можна застосовувати і для розділення суміші висококиплячих речовин, з яких лише одна відганяється з парою.
Згідно із законом Дальтона сумарний тиск (Р) пари суміші, яка переганяється, є сумою парціальних тисків пари води (Рв) та нерозчинної у воді речовини (Ра):
Р = Рв + Ра.
Температура кипіння такої суміші при атмосферному тиску завжди буде нижче 100 °С, тобто цей спосіб дозволяє розділяти висококиплячі рідини, які нестійкі за температур, вище 100 °C.
Деякі з речовин, для очищення яких застосовується метод перегон-ки з водяною парою, наведені в табл. 3.2.

Установка для перегонки з водяною парою зображена на рис. 3.5.

В колбу для перегонки із сумішшю води та речовини подають гарячу водяну пару. Утворена парова суміш направляється у похилий холодильник для конденсації, в результаті чого утворюється суміш двох нерозчинних одна в одній речовин, які легко розділяються.
Для отримання пари застосовують металевий паровик, який облад-наний запобіжною трубкою, що доходить практично до його дна і захищає систему від різкого підвищення тиску (наприклад, у випадку, коли трубка, що відводить пару, заб’ється смолою або твердими частинками, або у холодильнику утворяться кристали речовини тощо). Паровик заповнюють водою на 2/3 об'єму і нагрівають до кипіння.
Колбу для перегонки закріплюють похило (≈ 60° до горизонтальної площини), щоб бризки через паровідвідну трубку не потрапляли в холодильник. Речовину разом з невеликою кількістю води поміщають в колбу для перегонки (1/5 об'єму колби), яку щільно закривають гумовою пробкою з двома трубками – одна з них з'єднується з паровиком (після закипання в ньому води), а інша – з холодильником. При перегонці твердих речовин алонж не використовують. Щоб водяна пара не конденсувалася у колбі, її можна підігрівати за допомогою електронагрівача (колбонагрівача). Подачу води в холодильник припиняють, якщо спостерігається затвердіння конденсату в холодильнику. Після розплавлення конденсату воду для охолодження холодильника включають дуже обережно, щоб холодильник не тріснув через різкий перепад температур.
Перегонку припиняють тоді, коли почне переганятися прозорий дистилят. Після закінчення перегонки від'єднують гумову трубку паровика, а потім припиняють його нагрівання, інакше при охолодженні в ньому створюється вакуум і рідина з колби для перегонки може бути втягнута до паровика.
Інколи закінчення процесу перегонки визначають за допомогою якісних реакцій. Так, наприклад, при перегонці аніліну закінчення процесу контролюють за допомогою бромної води – при наявності аніліну відбувається знебарвлення бромної води і утворення осаду 2,4,6-триброманіліну.
Далі відділяють органічну речовину від води:
- - фільтруванням, якщо продукт за кімнатної температури твердий, з наступним висушуванням та зважуванням;
- - екстракцією, якщо продукт рідкий, з наступним висушуванням ек-стракту та фракційною перегонкою.
3.2.1 Лабораторна робота.
Перегонка невідомої органічної речовини з водяною парою
Використовуючи теоретичні знання підрозділу 3.2, скласти установку, зображену на рис. 3.5, та провести очищення (виділення) органічної речовини перегонкою з водяною парою. Якщо перегнана речовина є рідкою, отриману суміш залишити для розділення екстракцією або перегонкою при атмосферному тиску. Речовину для очищення (перегонки з водяною парою) видає викладач. Результати досліду занести до табл. 3.3.

Контрольні запитання
1. Який фізичний закон покладено в основу методу перегонки з водяною парою?
2. Для очищення яких речовин застосовують перегонку з водяною па-рою?
3. Чи можна відділити бромбензол від нітробензолу перегонкою з водяною парою? Відповідь обгрунтувати.
4. З яких частин складається установка для перегонки з водяною па-рою?
5. Як отримують водяну пару для перегонки?
6. Чому колбу для перегонки закріплюють похило?
7. У якому випадку припиняють подачу води для охолодження холодильника?
8. Як визначають закінчення процесу перегонки?
9. Чому після закінчення процесу перегонки спочатку від’єднують паровик від колби для перегонки, і тільки потім припиняють його нагрівання?
10. Як розділяють суміш органічної речовини і води після завершення пе-регонки?
3.3 Екстракція та висушування органічних речовин
Екстракція – процес вилучення одного або кількох компонентів з розчинів або з твердих сумішей за допомогою вибіркових розчинників (екстрагентів). Спосіб ґрунтується на різній розчинності речовин у розчиннику або в двох різних розчинниках, які не змішуються між собою.
Наприклад, оцтова кислота добре розчиняється у воді і в органічних розчинниках – бензолі, спирті. Для екстракції оцтової кислоти з її водного розчину вибирають розчинник, який не змішується з водою – бензол. Тоді при доданні бензолу до водного розчину CH3COOH кислота перейде в бензольний шар. Повторюючи цю операцію кілька разів, можна видалити з води практично всю оцтову кислоту.
Із суміші кількох речовин також можна виділити одну з них, підібравши розчинник, який розчиняє лише цю речовину і не розчиняє інші.
Розчинник для екстрагування (екстрагент) повинен задовольняти певні вимоги:
- - екстрагент і розчин повинні значно відрізнятись за густиною;
- - розчинність речовини, яку видаляють в екстрагенті, має бути значно ви-щою, ніж у розчині;
- - екстрагент повинен мати не дуже високу температуру кипіння.
Як екстрагенти найчастіше застосовують бензол, дихлоретан, діетиловий етер, хлороформ, етилацетат тощо.
Ефективність екстракції залежить від коефіцієнта розподілу, який показує співвідношення концентрацій (concentration) даної речовини в двох розчинниках, що не змішуються між собою. Процес екстракції описується рівнянням:


Аналіз рівняння показує, що кількість речовини, яка залишиться у водному розчині, буде меншою, якщо проводити екстракцію кілька разів невеликими порціями розчинника, ніж одну екстракцію – всім об’ємом розчинника.
Екстрагування речовини здійснюють у товстостінних ділильних лійках (рис. 3.6).
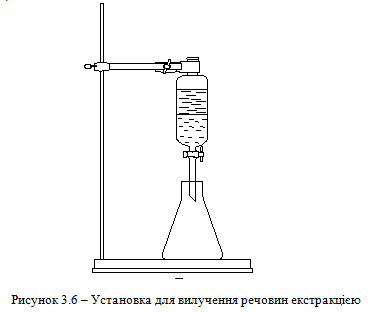
Процес екстрагування проводять у кілька стадій:
- - перевіряють герметичність ділильної лійки, для чого заповню-ють її водою. Якщо кран лійки у закритому стані пропускає воду, його змащують гліцерином;
- - закріплюють лійку вертикально і заповнюють її розчином та екстрагентом так, щоб загальний об’єм рідини не перевищував 2/3 об'єму лійки. Об'єм розчинника повинен дорівнювати приблизно 1/5 об'єму розчину;
- - закривають її пробкою і, тримаючи лійку в руках, обережно перемішують суміш, перевертаючи вверх і вниз протягом 5 – 10 хвилин. Періодично відкривають пробку (у її верхньому положенні) для вирівнювання тиску);
- - перевертають лійку пробкою вниз і відкривають кран для вирівнювання тиску (вирівнювання тиску проводять доти, доки тиск у лійці не буде змінюватися);
- - лійку закріплюють вертикально, після розшарування рідин зні-мають з лійки пробку і випускають нижній шар рідини у конічну колбу або хімічний стакан через кран;
- - верхній шар виливають через тубус лійки;
- - якщо при екстракції утворилась емульсія (emulsion), її можна зруйнувати, додаючи аміловий спирт або натрій хлорид;
- - одержані після екстракції розчини висушують дегідратуючими речовинами, а потім відганяють розчинник за допомогою перегонки при атмосферному тиску.
Висушування органічних рідин та розчинів
У багатьох випадках органічні розчинники, які застосовуються в хімічних лабораторіях, не повинні містити воду в помітних кількостях, оскільки при нагріванні це може привести до гідролізу речовин, які переганяються. Наявність води у розчині при перегонці веде до появи нових фракцій і, як наслідок, до втрат основного продукту.
Широкопоширені методи висушування органічних рідин за допомогою дегідратуючих речовин. Осушувач повинен задовольняти такі вимоги:
- - не повинен хімічно взаємодіяти як з розчинником, так і з розчи-неною речовиною;
- - не повинен каталітично сприяти самоокисненню, полімерізації і конденсації компонентів розчину;
- - не повинен помітно розчинятися в органічній рідині;
- - повинен зв'язувати воду швидко і ефективно;
- - повинен бути доступною речовиною.
У табл. 3.4 наведені найбільш поширені осушувачі та їх застосування.

Осушувачі зазвичай використовують у вигляді плавлених або про-жарених гранул діаметром 5 – 10 мм.
Рідину, яку треба осушити, наливають у плоскодонну колбу і додають осушувач. Якщо в процесі висушування не виділяється газ, то склянку щільно закривають пробкою з хлоркальцієвою трубкою. Висушування здійснюється протягом кількох годин.
Після закінчення висушування рідину фільтрують або зливають декантацією і переганяють.
3.3.1 Лабораторна робота.
Екстракція невідомої органічної речовини з бінарного
водно-органічного розчину та її висушування
Водний розчин органічної речовини об'ємом 10 мл екстрагують відповідним органічним розчинником (3×10 мл), а потім за допомогою ділильної лійки відділяють екстракт від водної фази.
Далі екстракт виливають в суху плоскодонну колбу, вносять певну кількість відповідного осушувача, закривають пробкою і залишають на одну годину.
За годину відмічають зміни, які свідчать про поглинання води з органічного розчину (розчин стає більш прозорим, осушувач збільшується в об'ємі).
Визначають об'єм висушеного екстракта, обережно переливають його в суху колбу Вюрца і проводять фракційну перегонку при атмосферному тиску.
Технічний розчин для екстракції отримують у викладача.
Контрольні запитання
1. Що покладено в основу вилучення та розділення речовин екстракці-єю?
2. Які вимоги повинен задовольняти екстрагент?
3. Назвіть основні стадії процесу екстракційного вилучення та розді-лення речовин.
4. Який хімічний посуд та обладнання застосовується при екстракції?
5. Який показник використовують для кількісної характеристики екстракційного вилучення речовин?
6. Від яких чинників залежить ступінь вилучення речовини в органічну фазу?
7. Як зменшити залишкову концентрацію речовини у водному розчині?
8. З якою метою проводять висушування органічних рідин?
9. Які дегідратуючі засоби застосовуються для висушування органічних рідин?
10. Які вимоги повинен задовольняти осушувач?
3.4 Виділення та очищення органічних речовин перегонкою
при атмосферному тиску
Метод перегонки застосовується для очищення і розділення суміші рідин, які відрізняються за температурами кипіння. Цей метод доцільний лише в тому випадку, коли речовина, яку переганяють, є стійкою до нагрівання і практично не розкладається при температурі кипіння.
Перегонка – це процес, який включає часткове випаровування суміші і подальшу конденсацію утвореної пари. В результаті конденсації пари одержують рідину, склад якої відрізняється від складу вихідної суміші. Розділення рідин перегонкою ґрунтується на різній леткості компонентів суміші за однієї температури, а тому при перегонці всі компоненти суміші переходять у пароподібний стан у кількостях, пропорційних їх леткості. Тобто, парова фаза завжди містить більшу кількість низькокиплячого компонента, ніж їх рідка суміш.
При випаровуванні встановлюється рівновага між рідиною і парою та відповідний тиск пари, значення якого залежить від природи рідини та температури, причому з підвищенням температури тиск пари над рідиною підвищується. Деякі сполуки утворюють суміші, при перегонці яких склад пари не відрізняється від складу рідини, тобто ці суміші киплять при однаковій температурі, а значить стають нероздільними. Такі суміші називають азеотропними.
Перегонку при атмосферному тиску доцільно застосовувати для рідин із температурою кипіння від 40 до 150 °С, оскільки за температури понад 150 °С більшість органічних сполук розкладаються, а інші – з температурами кипіння нижче 40 °С переганяються зі значними втратами.
При певній температурі тиск пари, що знаходиться над рідиною, не залежить від кількості рідини та пари, але зростає з підвищенням температури.
Рідина починає кипіти, коли тиск пари дорівнюватиме атмосферному тиску. За цих умов температура рідини більше не підвищується. При подальшому нагріванні киплячої рідини підвищується швидкість пароутворення.
Температура кипіння рідини – це температура, за якої тиск пари рідини в кожній точці над її поверхнею дорівнює атмосферному. Необхідно завжди вказувати тиск, при якому відбувається перегонка, наприклад: Ткип = 121 °С (753 мм рт. ст.). Зниження тиску викликає зменшення температури кипіння рідини і навпаки – підвищення тиску приводить до зростання температури кипіння. Вважають, що зниження атмосферного тиску на 10 мм рт. ст. викликає зменшення температури кипіння в порівнянні з температурою кипіння при 760 мм рт. ст. на 0,5 °С.
Для перегонки чистої речовини при атмосферному тиску застосовується установка (рис. 3.7), яка складається з колби Вюрца (1), термометра (2), похилого холодильника (3), алонжа (4) та приймача (5). Колбу Вюрца вибирають таких розмірів, щоб рідина в ній займала 2/3 об'єму.
Для перегонки низькокиплячих рідин, температура кипіння яких нижче 150 °С, застосовують колбу Вюрца з високоприпаяною трубкою та холодильник Лібіха.
Для перегонки висококиплячих рідин, температура кипіння яких вище 150 °С, застосовують колбу Вюрца з низькоприпаяною трубкою та повітряним холодильником. При перегонці таких речовин не слід застосовувати скляні холодильники з водяним охолодженням, тому що через різкий перепад температур холодильник може тріснути.
Рідини, які киплять вище 300 °С, переганяють без холодильника, його функцію виконує відвідна трубка колби Вюрца.

Складають установку для перегонки. Термометр, який показує температуру пари рідини, що переганяють, вставляють у колбу так, щоб кулька з ртуттю була розташована на 0,5 см нижче отвору відвідної трубки для забезпечення омивання кульки. Холодильник з’єднують з алонжем, який дозволяє знизити втрати низькокиплячої речовини за рахунок випаровування. У колбу наливають рідину, що підлягає перегонці, кладуть кип’ятильні камінці, які забезпечують рівномірне кипіння, та закривають горловину пробкою з термометром. Підставляють приймач для дистиляту і починають нагрівання. Не можна додавати кип’ятильні камінці в киплячу рідину, оскільки при цьому відбувається її бурхливе закипання. При перегонці рідина не повинна бурхливо кипіти, у іншому випадку вона може потрапити у відвідну трубку та забруднити дистилят.
При роботі установки з водяним холодильником потрібно постійно стежити за напором води в ньому: слабкий напір води або відсутність її в холодильнику може призвести до виходу пари в атмосферу, отруєння повітря і, тим самим, створити токсичну й вогненебезпечну обстановку.
Речовину не можна відганяти повністю. Перегонку припиняють, коли в колбі для перегонки залишається 1 – 2 мл рідини.
В залежності від температури кипіння рідини, яку переганяють, колбу нагрівають або на водяній бані (для речовин, температура кипіння яких нижче 80 °С), азбестовій сітці, або на піщаній бані. Температура бані не повинна перевищувати температуру кипіння рідини більш ніж на 25 °С. Горючі, легкозаймисті рідини, такі як діетиловий етер, переганяють на водяній бані, попередньо нагрітій на електричній плитці із закритим елементом. Горючі рідини з температурою кипіння понад 100 °С можна нагрівати на електроплитках.
Якщо здійснюють перегонку чистої речовини, показники термометра в процесі перегонки залишаються сталими. Практично чистою вважають речовину, яка переганяється в інтервалі температур з різницею в 1 – 2 °С.
Простою перегонкою можна розділити суміші речовин, температури кипіння яких значно (на декілька десятків градусів) відрізняються одна від одної. При простій перегонці не можна домогтися повного розділення суміші, але можна виділити окремі фракції: першу, яка містить більш летку (більш низькокиплячу) речовину, останню, яка містить менш летку (більш висококиплячу) речовину. Середня проміжна фракція буде складатись із суміші обох речовин, які розділяються.
3.4.1 Лабораторна робота.
Перегонка невідомої суміші органічних рідин при атмосферному тиску
Використовуючи теоретичні знання підрозділу 3.4, скласти установку, зображену на рис. 3.7, та провести очищення (виділення) органічної речовини перегонкою при атмосферному тиску. Речовину для очищення (перегонки при атмосферному тиску) видає викладач. Результати досліду занести до табл. 3.5.

Контрольні запитання
1. Які фізичні процеси лежать в основі перегонки?
2. Для виділення та очищення яких речовин доцільно застосовувати пе-регонку при атмосферному тиску?
3. Що називають температурою кипіння речовини і як її можна знизи-ти?
4. За якими ознаками можна відрізнити перегонку суміші від перегонки індивідуальної речовини?
5. Які колби застосовуються для перегонки висококиплячих рідин, які – для низькокиплячих рідин? Чому?
6. В яких випадках при перегонці застосовують: холодильник Лібіха, повітряний холодильник? У якому випадку як холодильник можна використовувати відвідну трубку колби Вюрца?
7. На якому рівні повинна знаходитись ртутна кулька термометра в колбі для перегонки? Чому при перегонці кінець холодильника з’єднують з алонжем?
8. Що може трапитись, якщо установка для перегонки не буде з'єднана з атмосферою?
9. Чому не можна опускати кип'ятильні камінці у киплячу рідину?
10. Які речовини можна розділити простою перегонкою? Чи можна при цьому досягти повного розділення суміші речовин?