15 ЛАЗЕРНІ БІОМЕДИЧНІ СИСТЕМИ
15.1 Принципи лазерної діагностики
Методи лазерної діагностики поділяються на мікродіагностичні (на рівні атомів і молекул) і макродіагностичні (на рівні клітин і органів). Мікродіагностика використовує всі засоби лінійної і нелінійної лазерної спектроскопії, а макродіагностика – методи пружного і квазіпружного розсіювання, інтерферометрію і голографію.
Лазерна спектроскопія виявляється особливо ефективною при дослідженні забруднень навколишнього середовища (флори і фауни, харчових продуктів і ін.) токсичними і патогенними речовинами. Навіть порівняно простий флюоресцентний аналіз у комбінації з хроматографією при використанні лазерів виявляється дуже чутливим. Лазерно-флюоресцентна спектроскопія з застосуванням сенсибілізаторів патологічних тканин, наприклад похідних гематопорфірину, виявляється дуже ефективною при ранній діагностиці онкологічних і інших захворювань [30].
Оптико-акустична спектроскопія має свої особливі переваги при дослідженні біологічних об'єктів, головна з яких полягає в малому впливі розсіювання на результати вимірювання спектрів поглинання, що дуже важливо для неоднорідних за структурою біологічних середовищ. Лазерне збудження і тут забезпечує високу спектральну роздільність, локальність аналізу, можливість використання волоконної техніки.
Жорстке фокусування потужних лазерних пучків використовується в цілому ряді методик, що реалізують мікроспектральний аналіз біологічних об'єктів.
Існують методи неруйнівного мікроспектрального аналізу, наприклад, лазерна мікрофлюорометрія окремих живих клітин або органел. Просторова і часова роздільність методу складає відповідно 0,3 мкм і 0,2 нс.
Лазерні імпульси пікосекундної і субпікосекундної тривалості знайшли застосування для вивчення первинних процесів фотосинтезу, зору і біохімічних реакцій за участю гемоглобіну, ДНК та інших біологічно важливих молекул. Ультрашвидкі процеси з характерними для біології фотофізичними і фотохімічними реакціями можуть займати дуже широкий діапазон, наприклад, для гемоглобіну 10-5 – 10-15 с. Дослідження цих процесів потребують застосування імпульсних лазерів і нових методик спектроскопії, включаючи спектроскопію комбінаційного розсіювання у наносекундному і пікосекундному діапазонах, швидкодіючі абсорбційні методи в часовому масштабі від наносекунд до фемтосекунд і пікосекундну флюоресцентну спектроскопію.
В основі біомедичної макродіагностики лежить використання лазерного випромінювання з високою монохроматичністю і когерентністю, що дозволяє вимірювати положення, швидкість, малі переміщення і форму різних компонентів біологічних об'єктів.
Голографія і інтерферометрія є потужними засобами діагностики взагалі, і біомедичної, зокрема. Голографічні методи дозволяють одержувати тривимірні зображення біооб'єктів, контури яких можуть бути картовані, а їх деформації проаналізовані в реальному масштабі часу. Ці нові можливості можуть вплинути на розвиток багатьох розділів медицини: ортопедію, радіологію, офтальмологію, урологію й отологію. Великі потенційні можливості в цьому сенсі має класична інтерферометрія з використанням лазерних джерел (наприклад, при створенні ретинометрів – пристроїв для визначення ретинальної гостроти зору), а також спекл-інтерферометрія (наприклад, для визначення структури і шорсткості деяких біотканин).
Пружне розсіювання при використанні лазерних джерел світла в поєднанні з повним аналізом поляризаційних характеристик індикатриси розсіювання дозволяє ефективно вивчати поглинальні, слабкоанізотропні двокомпонентні біотканини, наприклад, тканини ока. Пружне світлорозсіювання виявляється також ефективним у ряді задач імунології, вірусології і гематології. Застосування лазерів у цих дослідженнях дозволяє істотно спростити вимірювання і підвищити їх надійність [30].
Для розбивання каменів, утворених у різних органах людського організму, широкого поширення в медичній практиці набув відносно простий і дешевий метод лазерної інтракорпоральної літотріпсії. Інтенсивне лазерне випромінювання підводиться по гнучкому волоконному світловоду через природні або спеціально підготовлені канали до каменя, який руйнується під дією інтенсивного випромінювання. Найбільшого практичного використання в даній області набули лазери на барвниках з ламповим накачуванням мікросекундної тривалості. Відомі також дані про використання лазерів на ІАГ:Nd та александриті з модуляцією добротності. Недавно з цією метою було запропоновано використовувати ІЧ випромінювання лазера ІАГ:Nd, який працює в режимі вільної генерації.
В [31] наводиться опис процесу руйнування каменів, суть якого полягає в поглинанні каменем лазерного випромінювання, підведеного оптичним світловодом. Таке локалізоване поглинання енергії приводить до утворення плазми, яка потім розширюється.
Обмежені рідиною, пара і плазма утворюють порожнину, що являє собою кавітаційний пухирець. Цей пухирець зростає до максимального розміру і через кілька секунд руйнується. Ударні хвилі, наведені під час розширення плазми та руйнування пухирця, є причиною механічних напружень в камені. Необхідно, однак, відзначити, що для одержання більш повної картини процесів, що відбуваються під час лазерної дії на камінь та безпечнішого застосування в медицині, необхідно провести більш детальні дослідження [29].
Оптичну схему лазерної установки, що використовується в даних дослідженнях, наведено на рис. 33.
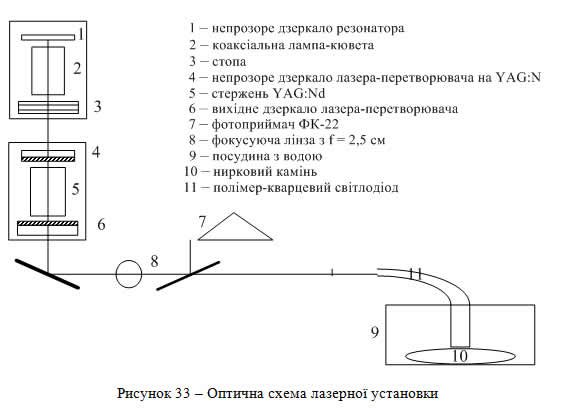
Випромінювання лазера на барвнику (1-3) або (при необхідності) лазера-перетворювача на ІАГ:Nd (4-6), що накачується лазером на барвнику, лінзою 8 з фокусною відстанню 2,5 см вводиться в полімер - кварцовий світлодіод 11 з діаметром світловодної жили 600 мкм – і підводиться безпосередньо до ниркового каменю 10, що знаходиться в посудині з водою 9. Для контролю енергії, підведеної до каменю, частина випромінювання скляною пластинкою відводиться на фотоприймач 7, калібрування якого проводиться за допомогою приладу ІКТ-2Н. Основою лазера на барвнику служить коаксіальна лампа. Розчин генеруючого барвника заливався в кварцову трубку з внутрішнім діаметром 8 мм, яка знаходилась всередині іншої кварцової трубки, що, в свою чергу, була стінкою коаксіальної лампи. Між цими двома трубками в зазорі товщиною 1,5 мм прокачувалась дистильована вода або етанольний розчин спеціально підібраного барвника, який забезпечував ефективне перетворення УФ-компоненти випромінювання лампи у випромінювання, що добре поглинається робочим розчином барвника, з метою підвищення енергетичної ефективності та ресурсу роботи лазерної системи.
Широке використання в хірургії знайшли ексимерні лазери (імпульсний режим), СО2-лазери, лазери на парах міді, ІАГ:Nd і ІАГ:Еr. Майже всі вони використовуються поряд з світловодами як хірургічні скальпелі.
Загалом можна виділити 4 режими опромінення біотканини (на основі дослідів з м'язовою тканиною тварин):
- при густині енергії 0,5 Дж/см2 в біотканині не спостерігається ніяких змін;
- при густині енергії від 1 – 10 Дж/см2 відбувається випаровування води з поверхневого шару. Утворюється висушена і частково коагульована біотканина товщиною 0,2 мм;
- при густині 10 – 100 Дж/см2 відбувається пошарове видалення біотканини. Товщина шару, який видаляється за кожний імпульс, пропорційна до густини енергії і залежить від параметрів лазерного імпульсу;
- при густині енергії більшій ніж 100 Дж/см2 утворюється лазерна плазма в парах біотканини і виникає ударна хвиля, яка приводить до розриву хімічних зв'язків.
На основі розроблених волоконних світловодів, здатних з малими втратами передавати оптичне випромінювання, створено медичні пристрої з гнучким лазерним скальпелем. Існує такий скальпель ІЧ-діапазону, де джерелом випромінювання є безперервний одномодовий СО2-лазер з максимальною потужністю 30 Вт. На виході з маніпулятора отримуємо пучок з діаметром ~500 мкм. Максимальна густина потужності в зоні впливу лазерного скальпеля досягає 10 кВт×см-2. Для візуалізації зони опромінення використовують світло Не-Ne лазера [29].
При проведенні хірургічного втручання, поряд з основними характеристиками лазерного випромінювання, важливу роль відіграє також фокусуюча оптика, від параметрів якої залежить глибина і конфігурація утвореного при опроміненні кратера.
15.4 Лазерно-люмінесцентна діагностика
Відомо, що найбільш перспективними на сьогодні мітками для люмінесцентної діагностики новоутворень, атеросклеротичних бляшок та : інших гіперпрофілювальних об'єктів визнані похідні гематопорфірину (ПГП), які характеризуються властивістю переважної локалізації саме в такого роду об'єктах при введенні їх в організм. Суттєвим недоліком всіх форм ПГП, які використовують з метою діагностики, є те , що внаслідок їх люмінесценції у видимому діапазоні (630 – 690 нм), одержана з їх допомогою люмінесцентна контрастність зображення пухлини чи інших об'єктів знижується внаслідок ефекту маскування фонової автолюмінесценції присутніх у біотканинах ендогенних речовин. Крім того, недоліком ПГП при їх використанні як люмінесцентних маркерів є фототоксичність цих препаратів, внаслідок якої протягом декількох тижнів необхідним є захист пацієнтів від попадання на шкіру яскравого світла [29].
Запропоновано метод волоконно-лазерної спектрофлуоресценції ближнього ІЧ-діапазону з використанням люмінесцентних маркерів новоутворень рідкоземельних комплексів порфіринів. Розроблення вказаного методу здійснювалася з врахуванням таких міркувань [29].
Відсутність фонової автолюмінесценції ендогенних речовин у біотканинах для даного спектрального діапазону, що дозволяє розраховувати на значне підвищення люмінесцентного контрасту таких діагностичних об'єктів, як злоякісні пухлини.
Низька фотохімічна активність рідкоземельних комплексів порфіринів, що дозволяє розглядати їх як спеціалізовані маркери люмінесцентної локалізації пухлин та інших гіперпрофілюючих об'єктів без характерної для традиційних порфіринів фототоксичності, яка є умовою ФДТ.
Діагностика медико-біологічних об'єктів, наприклад, пухлинних захворювань, з допомогою таких сенсорів може базуватися на вимірюванні як люмінесцентних, так і адсорбційних (відбивальних) характеристик цих об'єктів. Обмежуючись у даній роботі тільки люмінесцентним методом діагностики, відзначимо, що цей метод набагато переважає за чутливістю адсорбційний.
Крім того, недолік люмінесцентного методу, пов'язаний з фоновою автолюмінесценцією об'єкта, що підлягає діагностиці, істотно зменшується в запропонованому методі ІЧ-люмінесцентної діагностики.
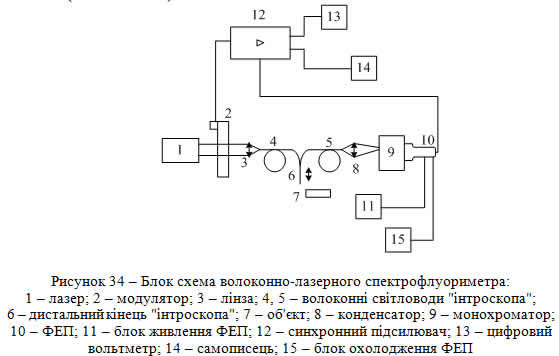
В основі використаного в експериментах методу волоконно-лазерної електрофлуориметрії лежить двоволоконний лазерний інтроскоп (ДВЛІ), принцип дії якого пояснює блок-схема на рис. 34. Як видно з цього рисунка, по ВС 4 передається збуджувальне випромінювання лазера 1, по ВС 5 – корисний сигнал-відгук від досліджуваного об'єкта 7. Джерелом випромінювання слугує лазер YAG:Nd з подвоєною частотою генерації lген = 532 нм. Потужність випромінювання, що потрапляє на досліджуваний об'єкт, складала 2 мВт. При діаметрі опроміненої ділянки, яка знаходиться на відстані 1,5 мм від ДВЛІ, рівному 1 мм, густина потужності не перевищувала 200 мВт/см2 – допустимої для біотканини величини. Реєстрація сигналу здійснювалася в широкій спектральній області (550 – 110 нм).
15.5 Техніка безпеки при роботі з лазерами
При роботі з лазерами необхідно забезпечити такі умови роботи, при яких не перевищуються гранично допустимі рівні опромінення очей та шкіри. Міри безпеки полягають у створенні захисних екранів, каналізації лазерного випромінювання по світлодіодах, використанні захисних окулярів тощо. Захисні окуляри повинні ретельно підбиратися, в залежності від робочої довжини хвилі лазерного світла, а їх спектр пропускання перевірятися. Окуляри повинні ефективно придушувати випромінювання на лазерній довжині хвилі, однак вони повинні бути не занадто темними.
Дуже небезпечним є відбите та розсіяне світло, особливо невидиме (УФ та ІЧ), оскільки напрямок відбитого випромінювання (наприклад, від металічних деталей установки) може бути абсолютно довільним та неконтрольовано змінюватися в процесі вимірювань. Дифузне відбиття (наприклад, від стін приміщення) та розсіювання світла самим випромінюючим тілом, що характерно для біологічних об'єктів, дає випромінювання у всіх напрямках. Для дифузного відбиття та розсіювання характерно, що на відстанях порядку розмірів лабораторної кімнати густина потужності на сітківці ока не залежить від відстані до об'єкта розсіювання. Це зв'язано з тим, що густина потужності на сітківці зменшується зі збільшенням відстані до об'єкта, однак фокальна пляма на сітківці при цьому також зменшується. Для усунення таких ефектів слід чорнити деталі експериментальних установок, по можливості огороджувати їх непрозорими екранами, робити спеціальне оброблення стін лабораторії [30].
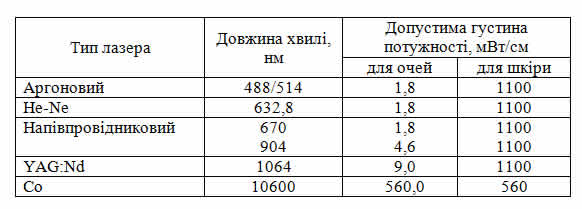
Визначено гранично допустимі для зору і шкіри дози випромінювання для різних груп лазерів. В таблиці 15.1 подано допустиму густину потужності випромінювання при часі експозиції в 1с для найбільш популярних медичних лазерів.
Контрольні запитання:
1. Які основні принципи лазерної діагностики ви знаєте?
2. Як здійснюється лазерна діагностика?
3. Сформулюйте особливості застосування лазерів в хірургії.
4. Які принципи покладені в основу лазерно-люмінесцентної діагностики?
5. Сформулюйте основні положення техніки безпеки при роботі з лазерами.