ЛАБОРАТОРНА РОБОТА № 4
АНАЛІЗ ДІАГРАМ СТАНУ ПОДВІЙНИХ СИСТЕМ
Мета роботи: навчитися робити аналіз діаграм стану різних типів, визначати наявність фаз та структур у сплавах різного хімічного складу при різних температурах; навчитись визначати кількість фаз або структурних складових в сплавах; навчитися визначати перетворення в сплавах.
Матеріали та обладнання. Для виконання даної лабораторної роботи студентам видаються рисунки діаграм стану систем різних типів з описанням механізму формування структур типових сплавів в цих системах.
Теоретичні відомості. Більшість металевих матеріалів, які використовуються в машинобудуванні – сплави, що складаються з двох, трьох або більшої кількості елементів. Основним елементом сплаву зазвичай є метал, який і визначає назву сплавів (сплави на основі заліза, міді, алюмінію тощо). Інші компоненти сплавів можуть бути як металами, так і неметалами. Їх додають до основного компоненту умисне для зміни структури та властивостей сплаву у бажаному напрямі.
Будь-який сплав складається з однієї або декількох фаз. Ними можуть бути: 1) чисті компоненти; 2) тверді розчини; 3) хімічні сполуки. Знання фазового складу є дуже важливим при дослідженні сплавів, але недостатнім для визначення їх властивостей. Більше інформації містить у собі структурний склад сплаву, тобто наявність у ньому певних структурних складових – окремих елементів мікроструктури, які відрізняються від інших. Кількість структурних складових металевої системи часто переважає кількість фаз, оскільки містить усі фази цієї системи, а також їхні суміші, що кристалізуються водночас і разом (евтектика, евтектоїд). Тому на діаграмах стану наводять не тільки фазовий, а й структурний склад для кожної їх області.
Діаграми стану або діаграми фазової рівноваги у зручній графічній формі показують фазовий і структурний склад сплавів залежно від температури та концентрації. Діаграми стану будують для умов рівноваги, які досягаються тільки при дуже малих швидкостях охолодження або тривалому нагріванні. Справжній рівноважний стан в практичних умовах досягається рідко. В більшості випадків сплави знаходяться в метастабільному стані, тобто такому, коли вони мають обмежену стійкість і під впливом зовнішніх факторів набувають інших більш стійких станів. В багатьох випадках метастабільні стани надають сплавам високих механічних або інших властивостей. Завданням металознавства є встановлення природи метастабільних станів, які забезпечували б оптимальний комплекс властивостей і розроблення режимів термічної або іншої обробки сплавів, що дозволяли б отримувати ці неврівноважені стани. Вихідним положенням при вирішуванні таких питань є знання діаграм стану. Саме діаграми стану дозволяють розробити раціональні режими різних видів обробки матеріалів і реалізувати їх на практиці. З іншого боку, вони дають можливість наукового прогнозу створення матеріалів з потрібними властивостями.
Вивчення будь-якої діаграми стану подвійної системи складається з двох етапів: 1) її загального опису; 2) аналізу процесу кристалізації типових сплавів. Доцільно поруч з діаграмою стану зображати криві охолодження сплавів, які аналізуються.
Основні типи діаграм стану
1. Діаграми стану системи, компоненти якої утворюють неперервний ряд рідких і твердих розчинів.
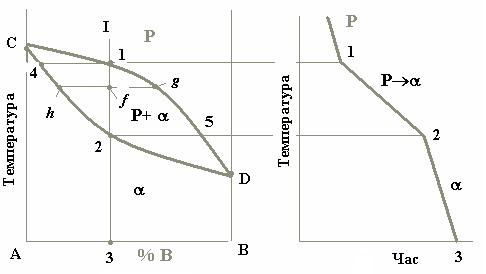
Така діаграма є однією з найпростіших. Вона містить у собі всього дві лінії (рис. 4.1, а). Верхня з них є лінією початку кристалізації будь-якого сплаву цієї системи і називається лінією ліквідусу (liquidus line). Нижня лінія є лінією кінця кристалізації усіх сплавів і є лінією солідусу (solidus). Вище від лінії ліквідусу розташована однофазна область рідкого розчину (Р). Нижче від лінії солідусу лежить також однофазна область a - твердого розчину. Між цими лініями знаходиться двофазна область, де співіснують обидва розчини (Р+a).
а б
Рисунок 4.1 – Діаграма стану системи, компоненти якої утворюють неперервний ряд рідких і твердих розчинів (а) та крива охолодження типового сплаву (б)
На діаграмі стану точки С і D є температурами кристалізації відповідно компонентів А і В. Сплав же будь-якої концентрації, наприклад сплав I, кристалізуватиметься в інтервалі температур між точками 1 і 2 і після повного охолодження (точка 3) буде мати остаточну структуру з зерен a-твердого розчину (рис. 4.2).
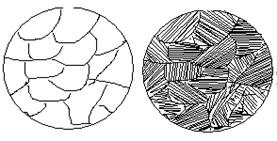
Рисунок 4.2 – Зображення мікроструктури твердого розчину (сплаву I)
Для більш детального аналізу процесу кристалізації цього сплаву потрібно скористатися правилом відрізків (правилом важеля):
Для визначення хімічного складу фаз, що перебувають у рівновазі одна з одною, через фігуративну точку сплаву проводять горизонтальну лінію до перетину з лініями діаграми, які обмежують дану область; проекції точок перетину на вісь концентрацій показують склади фаз. (Фігуративною точкою (figurative point) називається кожна точка в межах креслення діаграми стану. Вона зображає стан сплаву певного хімічного складу при певній температурі).
В нашому випадку фігуративною точкою є точка f , а точками перетину, про які йде мова, є точки h і g. Пряма hg, що з’єднує ці точки, називається конодою.
Правило відрізків (важеля) дозволяє визначити не лише хімічний склад фаз, але й їхню відносну й абсолютну кількість.
Для визначення кількості кожної фази через фігуративну точку проводять коноду; її відрізки обернено пропорційні кількості кожної з фаз.
Наприклад, у точці f у рівновазі знаходяться рідина складу точки g і a-фаза концентрації точки h. При цьому:
![]() ,
, ![]() .
.
Якщо скористатися цим правилом при аналізі процесу кристалізації сплаву I, то виявляється, що з рідини концентрації точки 1 виділяються кристали a-фази концентрації точки 4, тобто зовсім іншого складу.
Твердий розчин відносно рідини завжди збагачений тим компонентом, який підвищує температуру кристалізації сплавів.
У нашому випадку таким компонентом є А, отже, при будь-якій температурі a-фаза щодо рідкого розчину збагачена саме ним. При зниженні температури склад рідини змінюється вздовж лінії ліквідусу від точки 1 до точки 5, а склад a-фази – по лінії солідусу від точки 4 до точки 2 (рис. 4.1).
2. Діаграми стану систем з відсутністю взаємної розчинності компонентів у твердому стані
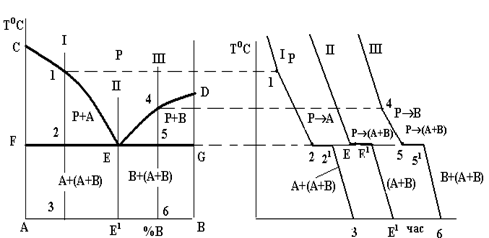
В діаграмах стану такого типу додавання як компонента В до компонента А, так і навпаки компонента А до компонента В, спричинює зниження температур кристалізації сплавів. З цієї причини лінія ліквідусу такої системи (рис. 4.3) опускається донизу з точок С і D. Обидві гілки лінії ліквідусу (СЕ і DE) перетинаються в точці Е. Кожна з цих гілок є як лінією початку кристалізації того або іншого компонента (СЕ – компонента А, DE – компонента В), так і лінією граничного насичення рідкого розчину відповідними компонентом: на лінії СЕ рідина гранично насичена компонентом А і при подальшому зниженні температури відбувається його кристалізація; на лінії ED – компонентом В, який теж буде кристалізуватися при подальшому охолодженні. Точка Е є спільною для обох кривих, отже, рідина такого складу гранично насичена обома компонентами, вони й будуть кристалізуватися одночасно і разом: РЕ ®(А+В) (читається: рідина складу точки Е перетворюється в суміш двох фаз, тобто компонентів А і В).
Суміш двох твердих фаз, які кристалізуються одночасно і разом з рідини певного складу, називається евтектикою (eutectic).
У кристалізації евтектики беруть участь три фази і згідно з правилом фаз система є нонваріантною, тобто кристалізація евтектики проходить при постійній температурі, що й видно на кривих охолодження.
а б
Рисунок 4.3 – Діаграма стану (а) і криві охолодження (б) системи з відсутністю взаємної розчинності компонентів у твердому стані
При кристалізації будь-якого сплаву цієї системи склад рідини буде змінюватися вздовж лінії ліквідусу до евтектичної точки Е, тобто кристалізація усіх сплавів закінчується утворенням евтектики. Оскільки це відбувається при постійній і однаковій для всіх сплавів температурі, то лінія солідусу даної системи є горизонтальною прямою FEG, яка називається лінією евтектичного перетворення.
Евтектична точка Е поділяє усі сплави на доевтектичні (ліворуч від точки Е) та заевтектичні (праворуч від точки Е). В окрему групу виділяється евтектичний сплав (на рис. 4.3, а) сплав II).
Розглянемо процеси кристалізації типових сплавів цієї системи. Доевтектичний сплав I кристалізується у два етапи. На першому в інтервалі температур 1-2 з рідини кристалізуються первинні кристали компонента (фази) А; потім в точці 2 рідина, що залишилася, закристалізується у вигляді евтектики. Отже, нижче точки 2 до точки 3, тобто до повного охолодження, сплав I буде мати структуру з двох складових: первинних кристалів компонента А та евтектики (суміші двох компонентів А і В) (рис. 4.4, а). Кількісний склад цих складових може бути визначений за правилом важеля. Так, кількість евтектики дорівнює відношенню довжини відрізка А-3 до довжини коноди А-Е1, а кількість фази А (компонента А) - відношенню довжини відрізка 3-Е1 до довжини А-Е1, тобто:
![]()
![]() .
.
Евтектичний сплав II має всього один етап кристалізації – утворення евтектики, і, таким чином, одну структурну складову – евтектику (рис. 4.4, б).
Заевтектичний сплав III кристалізується подібно до доевтектичного, але на першому етапі кристалізації з рідини виділяються кристали компонента В. Таким чином, кінцева структура заевтектичного сплаву складається з цих первинних кристалів і ділянок евтектики (рис. 4.4, в).
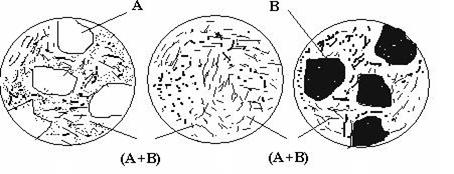
а б в
Рисунок 4.4 – Схеми мікроструктур доевтектичного (а), евтектичного (б) та заевтектичного (в) сплавів
3. Діаграми стану систем з обмеженою розчинністю компонентів у твердому стані
Такі типи систем найчастіше мають місце в металевих сплавах. При утворенні обмежених твердих розчинів зустрічаються два типи діаграм стану: з евтектичним і з перитектичним перетворенням.
Діаграма стану систем з утворенням обмежених твердих розчинів і евтектичним перетворенням (рис. 4.5)
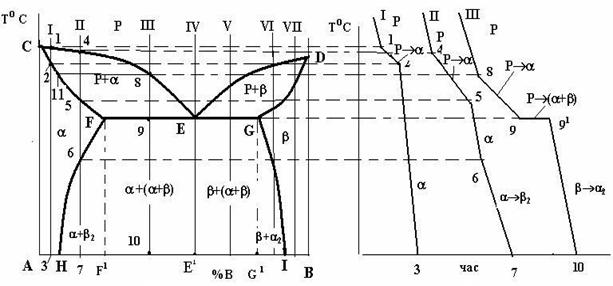
а б
Рисунок 4.5 – Діаграма стану (а) і криві охолодження (б) системи з обмеженою розчинністю компонентів у твердому стані з евтектичним перетворенням
Лінією ліквідусу на цій діаграмі є лінія СЕD, а лінією солідусу – лінія CFEGD. На горизонтальній частині цієї лінії FEG відбувається евтектичне перетворення: РЕ ®(aF +bG (читається: рідина складу точки Е перетворюється в суміш двох фаз - a-твердого розчину складу точки F і b-твердого розчину складу точки G) , де a і b - обмежені тверді розчини компонента В у компоненті А (a) і компонента А в компоненті В (b).
Крім цих ліній на діаграмі є і дві нові – лінії так званого сольвусу, тобто обмеженої розчинності у твердому стані – FH і GI. Перша з них показує границю розчинності компонента В у компоненті А, тобто граничний вміст компонента В в a-твердому розчині. Відповідно, лінія GI є граничним вмістом компонента А в b-твердому розчині. З положення цих ліній видно, що взаємна розчинність компонентів із зниженням температури зменшується.
Вказані лінії діаграми ділять її площу на 3 однофазні та 3 двофазні області. До однофазних належать область рідкого розчину (вище лінії ліквідусу CED), область CFHA a-фази і область DGIB b-фази. Двофазними є області CEF і DEG, в яких відбувається кристалізація первинних кристалів відповідно a- і b-твердих розчинів, а також область існування двох твердих розчинів a і b - HFGI. В цій області відбувається вторинна кристалізація, в якій, на відміну від первинної, не бере участі рідка фаза. Вторинна кристалізація полягає в тому, що після первинної кристалізації будь-якого сплаву, що лежить між точками H і I, і в складі структури якого є a- чи b-тверді розчини, ці тверді розчини при подальшому охолодженні до температур ліній сольвусів FH чи GI стають насиченими, а нижче цих ліній – перенасиченими. Оскільки стан перенасиченого твердого розчину є незрівноваженим, починається його розпад із виділенням надлишкового компонента.
Найчастіше це відбувається на межах зерен відповідного твердого розчину у вигляді окремих дисперсних часток або суцільних прошарків (рис. 4.6).
Як приклад розглянемо процеси кристалізації двох сплавів II і III. Первинна кристалізація сплаву II відбувається в інтервалі температур 4-5, де вся рідина закристалізується у вигляді a-твердого розчину. До точки 6, яка знаходиться на лінії сольвусу FH , цей розчин є ненасиченим компонентом В, у точці 6 він стає гранично насиченим, а нижче від неї – перенасиченим і при подальшому його охолодженні до точки 7 з нього виділяється надлишковий елемент – компонент В у вигляді b-твердого розчину (рис. 4.6).
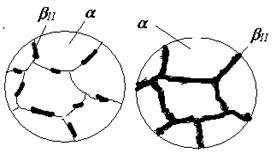
Рисунок 4.6 – Схеми мікроструктури сплаву II (рис. 4.5)
Таку остаточну структуру мають усі сплави в області FHF1 діаграми. Оскільки вторинна кристалізація відбувається в твердому стані при невисоких температурах, дифузія проходить досить повільно і вторинна кристалізація за описаним механізмом може відбутися досить повно тільки в умовах дуже повільного охолодження. В реальних же умовах кристалізації зберігається певне перенасичення a-фази компонентом В. Але перенасичений твердий розчин є нестійким і в подальшому довільно розпадається, що супроводжується суттєвою зміною властивостей сплаву, перш за все - механічних: підвищенням твердості та міцності, зниженням пластичності і в’язкості. Таке явище називається старіння або дисперсійне тверднення, яке широко використовується при термічній обробці кольорових металів, зокрема алюмінієвих сплавів (див. лаб. роботу № 9).
Аналогічно відбувається кристалізація сплавів, що знаходяться між точками G та I (наприклад, сплаву VI). Тільки в цих сплавах перенасиченим розчином є b-твердий розчин і з нього виділяється при охолодженні нижче лінії GI надлишковий компонент А у вигляді a-твердого розчину.
Кристалізація сплаву III відбувається в три етапи. На першому з них, в інтервалі температур 8-9, з рідини виділяються первинні кристали a-фази. Склад рідини при цьому змінюється вздовж лінії ліквідусу від точки 8 до евтектичної точки Е, а склад a-фази – по лінії солідусу від точки 11 до точки F. Другим етапом є евтектична кристалізація в точці 9:
РЕ ®(aF +bG).
Нижче від неї до точки 10 (до кімнатної температури) проходить вторинна кристалізація – розпад перенасиченого a-твердого розчину з виділенням вторинних кристалів bII. Водночас відбувається розпад b-твердого розчину, що входить до складу евтектики, з виділенням вторинних кристалів aII. Але вторинні кристали aII i bII не утворюють нових окремих структурних складових, а виділяються на вже існуючих тих же фазах евтектики. Тому остаточна структура цього сплаву III, як і будь-якого іншого доевтектичного сплаву, має всього дві складові: первинні кристали a-фази та евтектику (a+b), як показано на рис. 4.7.
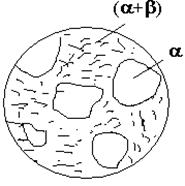
Рисунок 4.7 – Схема мікроструктури сплаву доевтектичного складу
Кристалізація будь-якого заевтектичного сплаву відбувається аналогічно, лише a - і b-фази міняються місцями.
Діаграми стану з перитектичним перетворенням (рис. 4.8).
Цей варіант діаграми реалізується тоді, коли температури кристалізації компонентів дуже відрізняються.
Лінія ліквідусу – CPD, солідусу – CNPD, сольвусу – NR I MQ.
Діаграма має три однофазні області: рідкого розчину (вище від лінії ліквідусу), a-фази (ACNRA), b-фази (QMDBQ) та три двофазні – рідини та кристалів a (CNPC), рідини та кристалів b (MPDM), кристалів a- і b-твердих розчинів (RNMQR). В останній області можна виділити окремо області RNN1R з a-фазою та вторинними кристалами bII – (a+bII) і MQM1M (b+aII).
На лінії NMP відбувається перитектичне перетворення: рідина та кристали, що раніше виділилися з неї, у взаємодії між собою утворюють нову тверду фазу: РР+aN®bM (читається: рідина складу точки Р і кристали a-фази складу точки N перетворюються на кристали b-фази складу точки М). Остання реакція перитектичного перетворення відбувається з повним використанням двох вихідних фаз лише для одного сплаву – складу точки МI. Для будь-якого іншого сплаву одна з вихідних фаз буде надлишковою і частина її залишиться після перитектичного перетворення. Так, для будь-якого сплаву, що лежить між точками N і M (наприклад, сплаву III), надлишковою фазою буде a-фаза, а для сплавів між точками M і P (наприклад, сплавів IV i V) надлишковою фазою буде рідина.
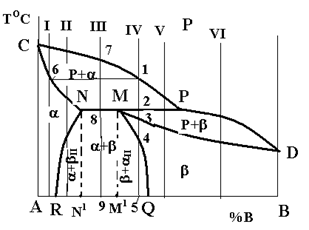
Рисунок 4.8 – Діаграма стану системи з обмеженою розчинністю компонентів у твердому стані і перитектичним перетворенням
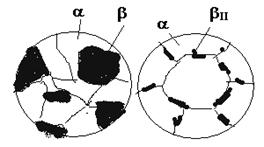
Структура сплаву III після повного охолодження складатиметься з кристалів b-фази, що утворилися при перитектичному перетворенні, та кристалів a-фази, що вціліли при перитектичному перетворенні (рис. 4.9, а). При охолодженні цього сплаву від точки 8 до точки 9 з цих фаз виділяються вторинні кристали (відбувається вторинна кристалізація: a®bII; b®aII ), але нові структурні складові, як це було зазначено раніше, не утворюються.
В сплаві IV при охолодженні від точки 1 до точки 2 з рідини виділяються первинні кристали a-твердого розчину, склад яких змінюється по лінії солідусу від точки 6 до точки N. Водночас склад рідини змінюється вздовж лінії ліквідусу від точки 1 до точки Р. На лінії NM фази такого складу взаємодіють між собою за перитектичною реакцією з утворенням b-фази. Після перитектичного перетворення в точці 2 залишиться в надлишку рідка фаза і при охолодженні від точки 2 до точки 3 з неї виділяються вже первинні кристали b-твердого розчину. При охолодженні сплаву IV від точки 3 до точки 4 матимемо однофазний b-твердий розчин, в якому ніяких змін не буде. В точці 4 b-твердий розчин стає гранично насиченим компонентом А і при подальшому його охолодженні в інтервалі температур 4-5 відбувається вторинна кристалізація з виділенням кристалів bII (рис. 4.9, б)
а б
Рисунок 4.9 – Схеми мікроструктур сплавів III (а) і IV (б) (рис.4.8)
1. Діаграми стану систем з хімічними сполуками
У подвійних системах можуть утворюватись хімічні сполуки між компонентами із загальною формулою АmBn. Найчастіше ці хімічні сполуки утворюються безпосередньо з рідини: Р®Аm Bn
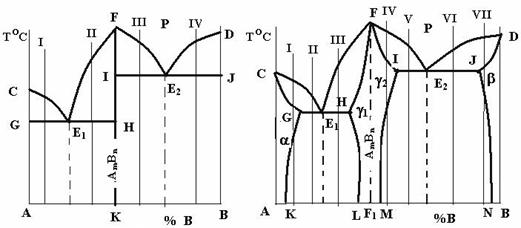
Конкретний вигляд діаграми визначається взаємодією її компонентів, передусім розчинністю їх у твердому стані, а також наявністю певних перетворень. При цьому хімічна сполука розглядається як окремий компонент. На рис. 4.10 показані два можливих варіанти: а – з відсутністю розчинності компонентів у твердому стані і б – з утворенням обмежених твердих розчинів на основі як чистих компонентів, так і хімічної сполуки — a-, b- і g-фаз.
а б
Рисунок 4.10 – Діаграми стану систем з хімічними сполуками
Систему, діаграма стану якої зображена на рис. 4.10, а, можна розглядати як сукупність двох систем з компонентами А і АmBn та B і AmBn.. Ці дві системи розділені вертикаллю FK. У кожній з підсистем утворюється власна евтектика – Е1 як суміш двох фаз – (А + АmBn) і Е2 ( В+ АmBn). Кристалізація і формування структур, наприклад, сплавів I, II, III, IV відбувається аналогічно тим, що були розглянуті нами в п. 2 та на рис. 4.3 цієї лабораторної роботи.
Для систем, діаграма стану яких показана на рис. 4.10, б, характерним є утворення обмежених твердих розчинів: твердого розчину хімічної сполуки AmBn в компоненті А – a-фази; твердого розчину хімічної сполуки в компоненті В – b-фази та твердих розчинів компонентів А і В в хімічній сполуці – відповідно g1-фази і g2-фази. Зазвичай ці тверді розчини g1 і g2 розглядаються як один твердий розчин — g-фаза. Тому на діаграмі (рис. 4.10, б) область FIMLHF розглядається як однофазна з твердим розчином g. Пунктирна лінія FF1 ділить цю область на дві частини: ліворуч від неї g-фазу можна вважати твердим розчином компонента А в хімічній сполуці AmBn, праворуч – твердим розчином компонента В в цій же сполуці.
Евтектики в цій системі складаються з суміші кристалів твердих розчинів:
Е1(a+g), Е2(g+b).
Кристалізація сплавів і формування остаточних структур в цій системі відбувається аналогічно розглянутих в п. 3.1 і на рис. 4.5 цієї лабораторної роботи.
2. Діаграми стану систем з поліморфними компонентами
Поліморфні перетворення одного або обох компонентів сплаву суттєво змінюють його структуру і властивості. Такі перетворення є в багатьох промислових сплавах, наприклад, сплавах заліза, титану та ін.
Конкретний вигляд діаграми стану визначається не тільки взаємодією компонентів, а і їх поліморфних модифікацій. Крім того, важливу роль відіграє наявність або відсутність взаємної розчинності компонентів та їх поліморфних модифікацій у твердому стані. Тому діаграми стану з поліморфними компонентами надзвичайно численні. Розглянемо тільки одну систему, в якій обидва компоненти є поліморфними і їх високотемпературні модифікації (Аb і Вb) утворюють неперервний ряд b-твердих розчинів (рис. 4.11), а низькотемпературні Аa і Вa - обмежені a- і a1- тверді розчини.
Лінії KE і EL, на яких починається перетворення b-твердого розчину, перетинаються в одній точці Е, яка називається евтектоїдною, а лінія GEH — лінією евтектоїдного перетворення: bЕ®(aG+a1H) (читається: твердий розчин b – складу точки Е розкладається на суміш двох фаз — твердого розчину a – складу точки G і твердого розчину a1 – складу точки Н.
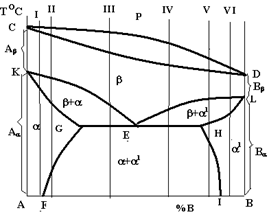
Рисунок 4.11 – Діаграма стану системи, компоненти якої мають поліморфні перетворення
Лінії GF i HI на діаграмі стану є лініями сольвусу. Сплави в інтервалі між точками G і E називаються доевтектоїдними, а сплави в інтервалі між точками E і H – заевтектоїдними. Схеми структур цих сплавів зображаються аналогічно тим, які зображені на рис. 4.4.
Завдання на роботу
1. Уважно вивчити теоретичний матеріал.
2. Зробити аналіз діаграми стану згідно з таблицею 4.1:
3. Скласти звіт про роботу, в якому повинні бути: рисунок діаграми стану заданої Вам системи; лінія вашого сплаву на діаграмі стану; крива охолодження сплаву з рідкого стану до кімнатної температури (поруч з діаграмою стану); описання процесу кристалізації сплаву і перетворень, які відбуваються в сплаві після його кристалізації, тобто в твердому стані, включно до кімнатної температури; розрахунки кількості фаз і структурних складових у сплаві при кімнатній температурі; рисунок структури заданого сплаву при кімнатній температурі; висновки.
Таблиця 4.1 – Варіанти індивідуальних завдань
№ варіанта |
Рисунок |
Сплав |
№ варіанта |
Рисунок |
Сплав |
1 |
3.12, в |
1 |
8 |
3.12, б |
II |
2 |
3.12, а |
III |
9 |
3.12, е |
I |
3 |
3.12, б |
I |
10 |
3.12, а |
I |
4 |
3.12, е |
IV |
11 |
3.12, г |
III |
5 |
3.12, а |
II |
12 |
3.12, е |
II |
6 |
3.12, в |
II |
13 |
3.12, г |
II |
7 |
3.12, г |
I |
14 |
3.12, е |
III |
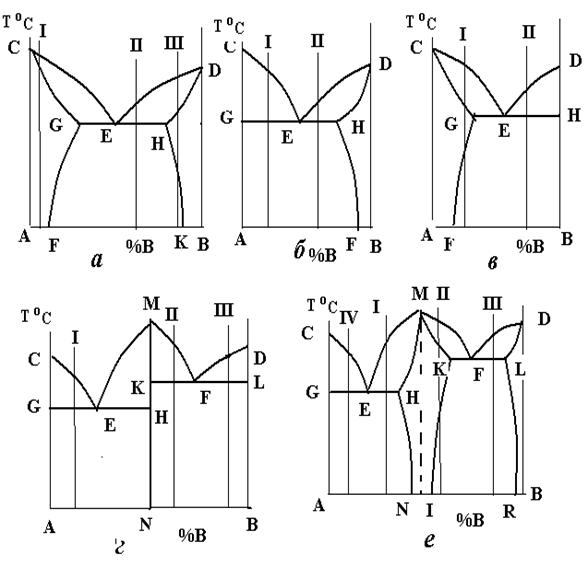
Рисунок 4.12 – Діаграми стану для індивідуального завдання
Контрольні питання для самопідготовки
1. Який сплав називається евтектичним?
2. Як формулюється і записується правило важеля?
3. Як формулюється правило фаз?
4. Як виглядають діаграми стану систем:
5. Яке перетворення називається евтектичним? Як записується його реакція?
6. Яке перетворення називається перитектичним та як записується його реакція?
7. Яке перетворення називається евтектоїдним та як записується його реакція?
8. Яка лінія на діаграмі називається сольвус?
9. З яких фаз складається микроструктура доевтектичного складу?
10. З яких фаз складається микроструктура заевтектичного складу?
11. З яких фаз складається микроструктура зевтектичного складу?
12. З яких фаз може складатися будь який сплав?