2.3.4 Хімічні властивості алкенів Розглядаючи хімічні властивості алкенів, необхідно відзначити зага-льний принцип систематизації при вивченні органічних сполук: хімічні властивості визначаються наявною функціональною групою та атомами, що її оточують. У випадку алкенів функціональною групою є подвійний зв’язок (потенційний нуклеофільний центр), для якого характерні реакції приєднання, а не реакції заміщення, що характерні для раніше розглянутих алканів. Для алкенів також характерні реакції окиснення та полімеризації. Хімічна активність подвійного зв’язку буде визначатись, перш за все, значною поляризовністю -зв’язку (енергія дисоціації рівна приблизно 271 кДж/моль) та просторовою доступністю до реакційного центру. Гідрування (гідрогенізація) алкенів у більшості випадків відбувається при дії каталізаторів платинової групи (Pt, Pd, Ni): 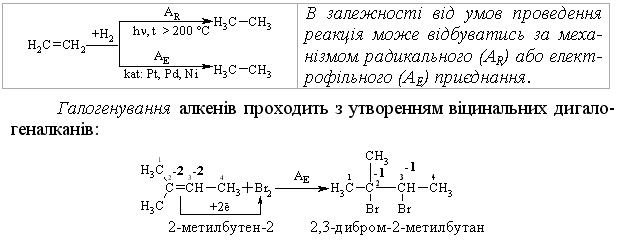 Бромування це якісна реакція на алкени. Бромна вода темно-червоного кольору знебарвлюється у присутності алкену внаслідок утво-рення дибромгалогеналкану. Реакцію бромування алкенів в загальному ви-гляді можна розглядати як окисно-відновну, в якій алкен окиснюється до дибромгалогеналкану, а молекулярний бром відновлюється до бромід-аніону, що входить до складу 2,2-дибром-2-метилбутану. Швидкість реакції галогенування залежить від природи галогену: F2 (з вибухом) > Cl2, Br2 (кімнатна температура) > I2 (повільно при освітлені, h), а також від будови алкену: 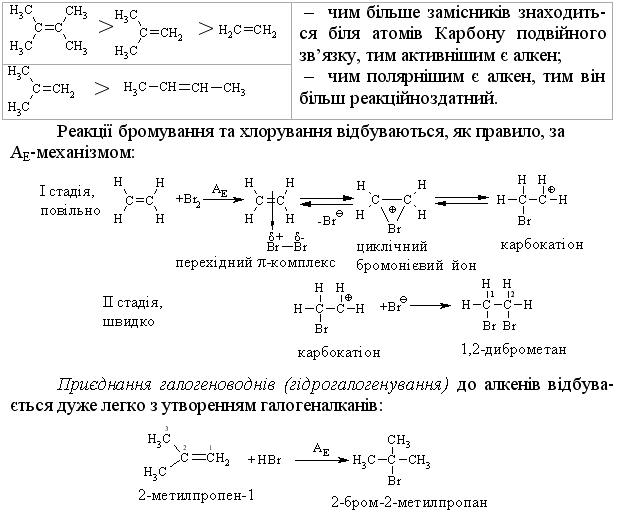 Реакційна здатність галогеноводнів зростає із збільшенням сили кис-лот у ряду: HF < HCl < HBr < HI. Галогеноводні у випадку несиметричних алкенів приєднуються за правилом В.В. Марковнікова (1869 р.): атом Гідрогену приєднується до більш гідрогенізованого атома Карбону (до атома Карбону, що має більшу кількість атомів Гідрогену). Така регіоселективність визначаєть-ся поляризацією подвійного зв’язку в алкенах з утворенням на першій ста-дії перехідного -комплекса: 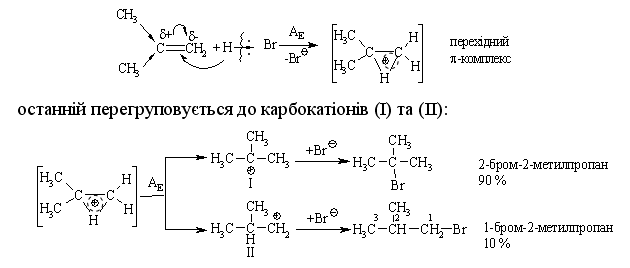 Із двох проміжних карбокатіонів І та ІІ перший є більш стійким, тому і вихід кінцевого бромалкана у цьому випадку є визначальним (90 %). При наявності у реакційному середовищі пероксидів реакція іде не за АЕ механізмом, а за радикальним механізмом – AR (Хараш, 1933 р.): 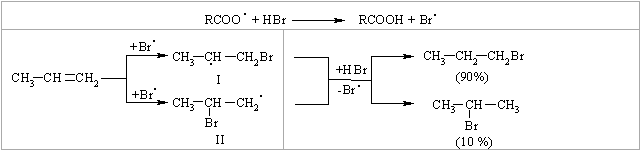 радикал І є більш стабільним, ніж радикал ІІ, що є визначальним при утво-ренні кінцевого 1-бромпропану (90 %). Радикали І та ІІ стабілізуються за рахунок взаємодії із наступною молекулою бромоводню. Таким чином, наявність в реакційному середовищі пероксидів приво-дить до зміни механізму реакції та до приєднання галоген оводнів всупереч правилу Марковнікова. Приєднання води (гідратація) (hydration) алкенів відбувається в при-сутності мінеральних кислот за схемою: 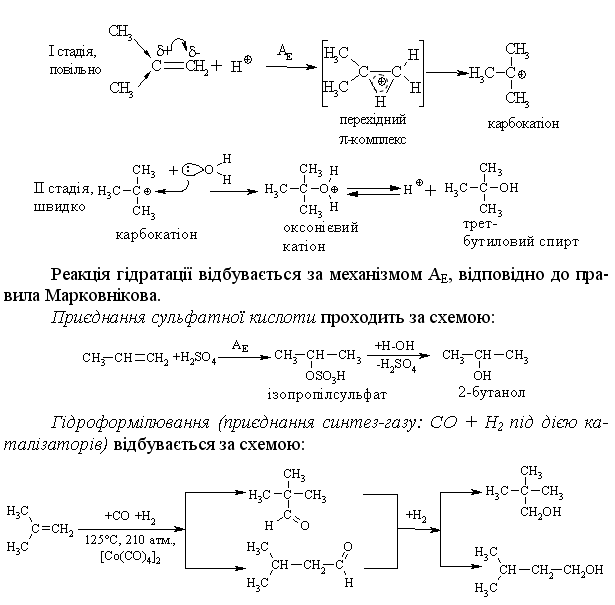 Промисловий метод добування альдегідів, які легко відновлюються до відповідних спиртів, було розроблено в США. Окиснення алкенів. Окиснення відбувається дуже легко, а характер продуктів реакції за-лежить від природи окисника та умов перебігу реакцій. Окиснення без розриву подвійного зв’язку в олефінах. Реакція Прилєжаєва (1912 р.):  |