3.1.3 Будова ароматичних сполук. Критерії ароматичності Будову ароматичних сполук розглянемо на прикладі найпростішого представника аренів – бензену С6Н6 (М. Фарадей у 1825 р. вперше виділив бензен із світильного газу). Складу С6Н6 приписували різні структурні фо-рмули (Д. Дьюар, А. Ладенбург, І. Тіле). Найбільш вдалою виявилась фор-мула, запропонована А. Кекуле в 1865 році – шестичленний цикл з атома-ми карбону і простими та подвійними зв’язками:  Структура молекули бензену, що була запропонована А. Кекуле, мала ряд недоліків: не пояснювала відсутність ізомерних структур А і Б у 1,2-дизаміщених похідних бензену: 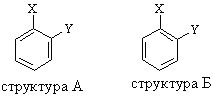 не пояснювала переважну схильність бензену до реакцій заміщення; не пояснювала високу термічну стійкість бензену та стійкість до окиснення.. Тобто така структура бензену не узгоджувалась з рядом експеримен-тально встановлених фактів. Згідно з сучасними уявленями про будову атома (Н. Бор, 1913 р.), те-орією ковалентного зв’язку (К. Інгольд, 1926 р.), квантово-механічними розрахунками (Л. Полінг), запропоновано сучасну модель будови молеку-ли бензену. За результатами рентгеноструктурного аналізу встановлено, що молекула бензену є плоским правильним шестикутником з валентним кутом 120 °, у якому всі атоми карбону знаходяться у sp2-гібридному стані. На рис. 3.1 наведено орбітальну модель утворення -зв’язків у молекулі бензену. -Зв’язок у молекулі бензену утворюється при осьовому перекри-ванні S-атомних орбіталей атома гідрогену і гібридизованих sp2-орбіталей атома карбону (6 -зв’язків) та перекриванні sp2-гібридизованих орбіталей атомів карбону між собою (6 -зв’язків). Негібридизовані pz-орбіталі атомів карбону беруть участь в утворені 6-електронної супряженої ароматичної системи, рис. 3.2. 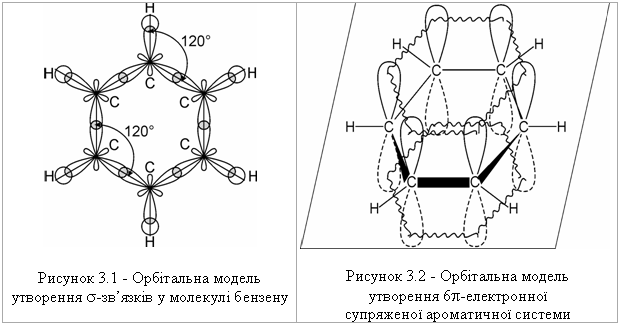 Супряжений ароматичний секстет бензену утворюється при взаєм-ному (двосторонньому) перекриванні негібридизованих pz-орбіталей ато-мів карбону. Це приводить до делокалізації р-орбіталей з утворенням на їх основі стабільної 6-електронної супряженої ароматичної системи. Експе-риментально встановлено, що супряження в бензеновому циклі обумовлює значне зменшення вільної енергії бензену у порівнянні з розрахованим значенням вільної енергії циклогексатриєну. Ця різниця складає 150,7 кДж/моль і називається енергією супряження. Можна стверджувати, що в бензені не існує простих або подвійних зв’язків, що підтверджують дані, що наведені в табл. 3.1. 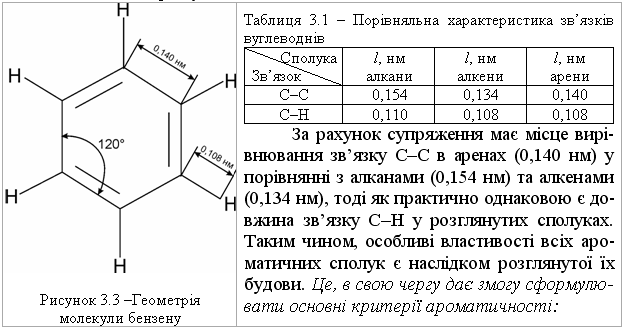 молекула повинна бути циклічною та плоскою; молекула повинна мати замкнений ланцюг супряження -електронів; кількість -електронів (N) у ланцюгу супряження повинна відповіда-ти правилу Хюккеля (Е. Хюккель, 1931 р.): N = 4n + 2, де n = 0,1,2,3... Наприклад: 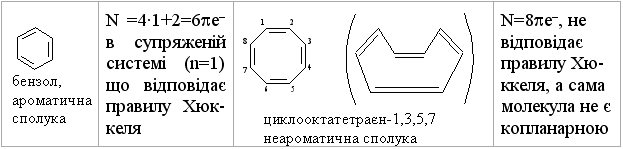 Якщо сполука відповідає всім критеріям ароматичності, то енергія супряження у таких молекулах досягає максимального значення, а сама сполука внаслідок цього стає надзвичайно стабільною. Тому енергія суп-ряження є головним критерієм ароматичності. |