4.4.3 Екологічні питання Екологічні питання пов’язані з виробництвом та використанням су-льфурвмісних сполук у синтетичній органічній хімії, промисловості та ін-ших галузях діяльності людини. Охарактеризуємо деякі найважливіші су-льфурвмісні сполуки.  Іприт – безбарвна масляниста рідина із слабким запахом касторової олії (Ткип. = 217 °С); добре розчинна у CCl4, CHCl3, хлорбензені, в синтети-чних естерах і природних жирах. Деякі токсичні характеристики іприту наведені у табл. 4.19. 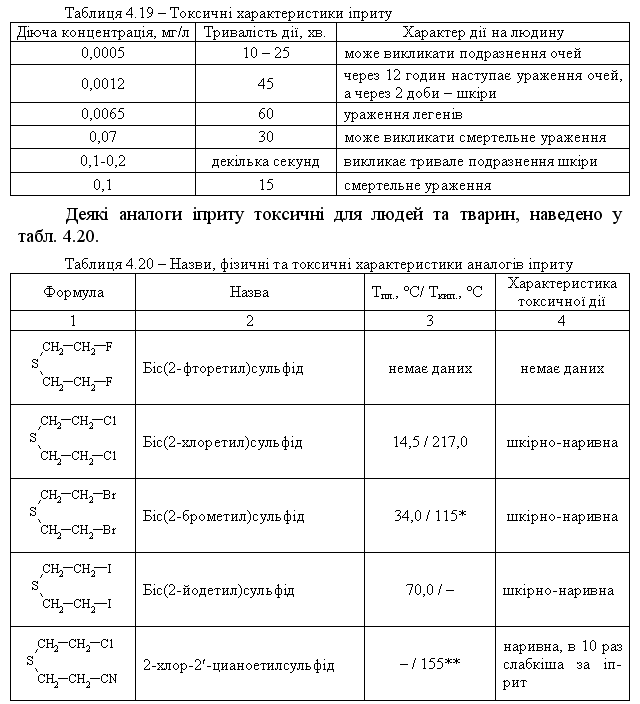 Примітки: * при 1 мм. рт. ст.; ** при 15 мм. рт. ст. Дегазація іприту. Реагентні методи знезараження базуються на реакціях обміну гало-генів на інші атоми і групи (–OH, >NH, –CN, –OR, >S). При дегазації іприту холодною водою реакція відбувається повільно; при обробці киплячою – швидше. При дії водного розчину лугу (NaОН, КОН) гідроліз відбувається швидше, але солі, що утворюються (NaCl, KCl) та надлишок лугу зменшують розчинність іприту у воді і реакція сповіль-нюється: 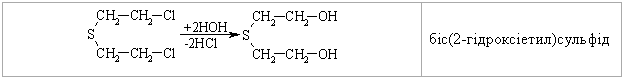 На практиці для дегазації іприту використовують сухе хлорне вапно (Ca(OCl)Cl), яке є одночасно окисником та хлоруючим агентом для іприту. Перебіг реакції бурхливий, іноді із самозапалюванням суміші. Нерідко для дегазації використовують хлорамін Т: 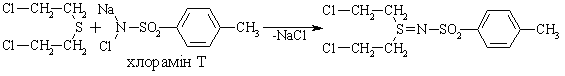 Ця реакція досить ефективна. Офіційних даних про знаходження залишкових кількостей бойових токсичних речовин (ТР) немає, але світова громадськість не виключає мо-жливість збереження іприту в деяких країнах на військових складах. За не-офіційними даними багато бойових ТР після Другої світової війни було за-топлено у Балтійському морі та у Мексиканській затоці Атлантичного оке-ану. Іншу групу токсичних речовин, які містять сульфідний фрагмент, складають пестицидні препарати (інсектициди та фунгіциди), які заборо-нені, зняті із виробництва, але все ще знаходяться на багатьох складах України. Від високотоксичних бойових ТР їх відрізняє значно менша ток-сичність по відношенню до комах, тварин та людини, але прихована загро-за пов’язана з продуктами їх розкладу, які за токсичними властивостями значно перевершують вихідні сполуки. Такі процеси не досліджені (особ-ливо в неопізнаних сумішах багатьох пестицидних препаратів) і проходять неконтрольовано. Деякі препарати, за винятком значної групи похідних дитіофосфорної кислоти, наведені у табл. 4.21. 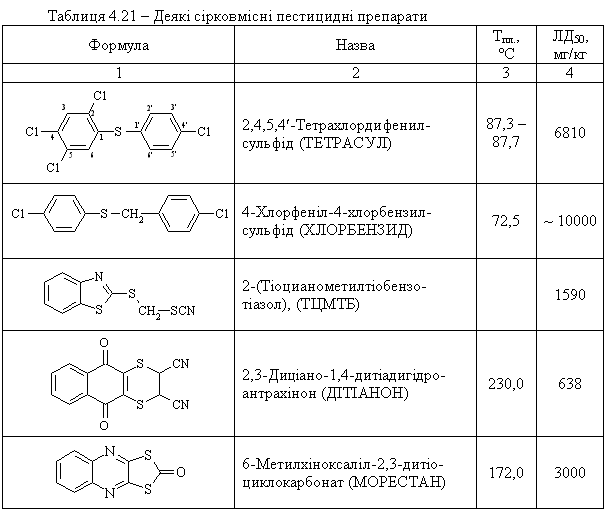 Примітки: ЛД50 наведено для пацюків; в дужках промислові (товар-ні) назви пестицидних препаратів. Цікаво відмітити, що навіть такий широко відомий сульфідний пре-парат, як „вапняно-сірчаний відвар” (полісульфід кальцію – CaSSX), що в побуті вважається нешкідливим є високотоксичною речовиною. При по-траплянні в організм людини може викликати смертельне отруєння, вияв-ляє подразнюючу дію на шкіру. Тому при його приготуванні і роботі із ним слід ретельно захищати очі, шкіру та органи дихання від контакту з цією речовиною. Знезараження пестицидних препаратів. В Україні немає спеціально розроблених ефективних методів знеза-раження пестицидних препаратів, відсутня і наукова методологія та розро-бка базових технологій для проведення таких робіт. Як правило, переробка зводиться до їх спалювання, контейнеризації або захоронення на спеціаль-но відведених майданчиках, що принципово не вирішує важливої екологі-чної проблеми. Перспективним у цьому плані є напрямок реагентної пере-робки таких токсичних речовин, наприклад, як у випадку дегазації іприту. Серед інших сульфурвмісних сполук широко використовується як розчинник в органічній практиці диметилсульфоксид. Розглянемо його властивості. 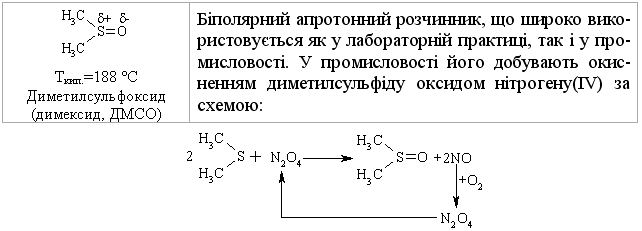 Оксид нітрогену(ІІ), який при цьому утворюється як супутній газ, доокиснюється киснем повітря до N2O4 та повертається в технологічний цикл. Малотоксичний: ЛД50 для білих мишей 20000 мг/кг. Дуже легко про-никає через шкіру тварини та людини. Питання для самоконтролю 1. Запропонувати синтез 2-метилбутантіолу-1 з 2-метилбутену-1. Назвати проміжні сполуки. 2. Навести способи добування метантіолу і написати схеми реакцій його окиснення: а) киснем повітря; б) НNО3. Назвати продукти реакцій. 3. Навести способи добування діетилсульфіду та ізомерного йому 1-бутантіолу. Навести і пояснити рівняння реакцій, з допомогою яких можна розрізнити ці сполуки. 4. На прикладі етанолу та етантіолу порівняти властивості спиртів та тіо-спиртів: а) здатність до асоціації; б) розчинність у воді; в) відношення до дії водних лугів і окисників. 5. Розташувати сполуки (а – в) за зростанням їх кислотних властивостей: а) 1-пропанол; б) метилацетилен; в) 1-пропантіол. Відповідь обґрунтувати. Навести методи добування 1-пропантіолу та схеми його реакцій: а) з вод-ним розчином лугу; б) окиснення у різних умовах. 6. Навести можливі структурні формули для сполуки загальної формули С4Н10S, якщо вона: а) не реагує з водним розчином лугу; б) при енергійному окисненні утворює сполуку С4Н10SО2; в) при нагріванні з СН3-I дає сполуку С5Н13SI. Навести рівняння відповідних реакцій, назвати продукти. 7. Навести структурну формулу сполуки, яка утворюється при взаємодії метантіолу з алкеном у кислому середовищі, якщо: а) її формула С4Н10S; б) вона не розчиняється в лугах; в) при окисненні в різних умовах утворює С4Н10ОS та С4Н10О2S. Навести схеми відповідних реакцій. 8. Встановити структурну формулу сполуки складу С4Н10S2, якщо: а) вона не реагує з лугом; б) при відновленні воднем перетворюється на сполуку, що розчи-няється в лугах і при енергійному окисненні перетворюється на продукт С2Н5SО3Н, розчинний в лугах. Написати рівняння відповідних реакцій, запропонувати спосіб добування сполуки С4Н10S2. 9. Порівняти будову етанолу та етантіолу (етилмеркаптану). Пояснити, чо-му етантіол кипить при температурі значно нижчій, ніж етанол (Т кип. 37°С і 78 °С відповідно). Пояснити, яка сполука має більш ״кислий״ характер і чому. 10. Навести структурну формулу сполуки С2Н6S2, якщо: а) вона реагує з NаОН у співвідношенні 1:2, розчиняючись у водно-му розчині лугу; б) при енергійному окисненні перетворюється на продукт складу С2Н6О6S2. Запропонувати метод синтезу сполуки С2Н6S2.
Самостійна робота 1. Збірник тестових завдань з органічної хімії / Під ред. проф. Рансько-го А. П. – Дніпропетровськ, 2007. – С. 110-112. – ISBN 966-8018-54-0. Основна література 1. Гауптман З. Органическая химия Гауптман З., Грефе Ю., Ремане Х. – М.: Химия, 1979. – С. 468-473. 2. Ластухін Ю. О. Органічна хімія / Ю. О Ластухін, С. А. Воронов. – Львів: Центр Європи, 2001. – С. 443-446. – ISBN 966-7022-19-6. 3. Черных В. П. Лекции по органической химии / В. П. Черных. – Харьков: Золотые страницы, 2005. – С. 201-223. – ISBN 966-615-155-3. Додаткова література 1. Грандберг И. И. Органическая химия / Грандберг И. И. – М.: Высшая школа, 1987. – С. 243-244. 2. Моррисон Р. Органическая химия / Моррисон Р., Бойд Р. – М.: Мир, 1974. – С. 667-674. 3. Штеменко Н. І. Органічна хімія та основи статичної біохімії/ Штеменко Н. І., Соломко З. П., Авраменко В. І. – Дніпропетровськ. Видавництво ДНУ, 2003. – С. 251-252. – ISBN 966-551-117-3. 4. Мельников Н. Н. Пестициды. Химия, технология, применение / Мельни-ков Н. Н. – М.: Химия, 1987. – 712 с. 5. Мельников Н. Н. Технические средства защиты растений. Справочник / Мельников Н. Н., Новожилов К.В., Пылова Т. Н. – М.: Химия, 1980. – 288 с. 6. Ранский А. П. Химия дитиокарбаматов. Сообщение І. Влияние раство-рителя на комплексообразование меди(0,I,II) с тиурамами и дитиокар-баматами / Ранский А. П., Тхор И. И., Петрук В. Г. // Вопросы химии и хим. технологии. – ISSN 0321-4095 2005, № 5. – С. 42-45. 7. Химия дитиокарбаматов. Сообщение ІІ. Десульфирование тиурамдису-льфидов действием нулкеофильных реагентов / Ранский А. П., Тхор И. И., Петрук В. Г., Охтина О. В. // Вопросы химии и хим. техно-логии. – ISSN 0321-4095. 2005, № 6. – С. 46-48. 8. Тхор І. І. Технологічні схеми реагентної переробки пестицидного препа-рату «Фентіурам» та його дерівату «тетраметилтіурамдисульфіду» (ТМТД) / Тхор І. І., Ранський А. П., Петрук В. Г. // Вісник ДУ Львівська політехніка. Хімічна інженерія та промислова екологія. – 2006. – № 553. – С. 204-209. 9. Тхор І. І. Реагентна переробка та раціональне використання екологічно небезпечних сірковмісних пестицидних препаратів: дис. ... канд. техн. наук: 21.06.01. – Вінниця, 2007 р. – 215 с. 10. Ранский А. П. Хроматографический контроль тетраметилтиурамдису-льфида во вторичных растворах утилизации пестицида Тиурам / Ранский А. П., Сандомирський А. В. // Вопросы химии и хим. технологии. – ISSN 0321-4095, 2004, № 2. – С. 47-50. |