11 БІОМЕДИЧНА АПАРАТУРА ВИСОКОЇ ІНТЕЛЕКТУАЛЬНОЇ СКЛАДНОСТІ
Томографічним методам дослідження передувала ціла епоха інтенсивних досліджень і відкриттів, які є фундаментом для нових уявлень про будову речовини і які потім знайшли практичне застосування в багатьох галузях науки і техніки, що пов’язані з будовою речовини. Ці дослідження і відкриття є попередниками появи томографії і її основою.
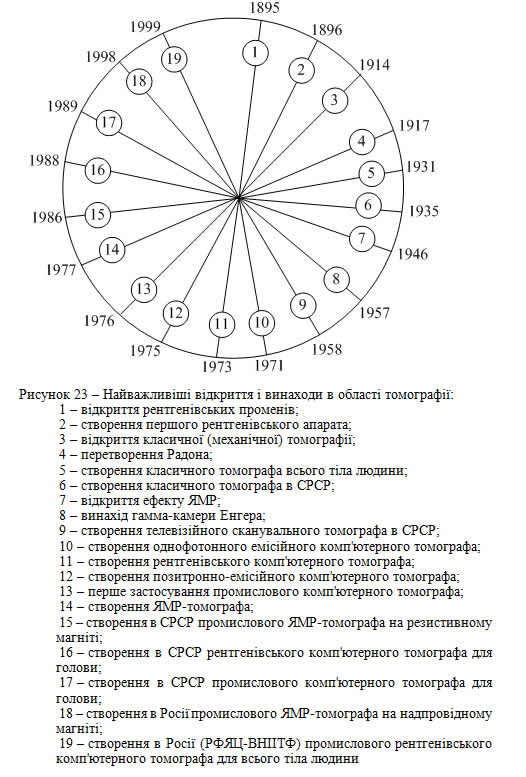
Видатні дослідники сучасності в області фізичної медицини [14, 16, 18, 19] початком ери візуалізації зображень вважають відкриття рентгенівського випромінювання, зроблене В. К. Рентгеном у 1895 р.
Наступні роки можна характеризувати як роки розвитку інженерної думки із створення рентгенівських апаратів, у тому числі і механічних апаратів класичної рентгенівської томографії.
Повідомлення про установку для одержання рентгенівських комп'ютерних томограм, зроблене Хаунсфілдом у 1972 р. на щорічній конференції Британського інституту радіології, можна вважати найзначнішою подією з часу відкриття Рентгена. Анотацію даного повідомлення, а також повідомлення за назвою "Рентгенівська діагностика проникає в глибини мозку", надруковане в журналі "New Scientist" у 1972 р., можна розглядати як фундаментальні основи медичної рентгенівської комп'ютерної томографії (КТ).
Перший комерційний промисловий зразок КТ для дослідження голови людини був зроблений у Великобританії в 1973 р. А перший промисловий зразок КТ для всього тіла людини був виготовлений в кінці 80-х років фірмою "Дженерал електрик" (США), це КТ "СТ-МАХ 640". Він став базовою моделлю томографа в Америці і Європі, вивів охорону здоров'я цих країн на новий якісний рівень.
У СРСР перший КТ (СРТ-1000) для голови був створений у 1988 р. у ВНДІ томографії. У 1999 р. у Росії був створений перший промисловий КТ (РКТ-01) для всього тіла людини в РФЯЦ – ВНІІТФ при участі Симонова.
Практично паралельно з застосуванням КТ у медицині розвивалась промислова КТ (ПКТ). І в цій області використання томографічних методів виявилося настільки ж значним, як і в медицині. В наш час промислова томографія охоплює застосування практично усіх видів іонізуючих випромінювань та їхніх енергій: рентгенівського, g-випромінювання, нейтронного, протонного, іонного. Необхідність застосування цих видів випромінювання була викликана потребою визначення якості різних типів промислових виробів, що відрізняються властивостями матеріалів, розмірами, конфігурацією. Не дивно, що цей метод ПКТ знайшов застосування в першу чергу при контролі якості дуже важливих, з погляду безпеки, виробів, таких як ТВЕЛ атомних реакторів, лопаті двигунів літаків і ракет, двигуни перших ступенів ракет.
Перше застосування ПКТ було здійснено в США в 1976 р. для контролю першого ступеня двигуна важкої ракети "Сатурн-5", що здійснив пілотований політ астронавтів на Місяць [16].
Перше промислове застосування КТ у СРСР було здійснено Е. Вайнбергом у 1989 р.
Як у медицині, так і в промисловості КТ починалася з трансмісійного виду сканування, коли джерело випромінювання знаходилося ззовні досліджуваного об'єкта. Однак одночасно з розвитком трансмісійної томографії розвивалася й емісійна томографія, коли радіоактивне джерело випромінювання знаходиться усередині досліджуваного об'єкта [18].
Необхідно відзначити ще один напрямок КТ, який у наш час бурхливо розвивається – це ЯМР-томографія.
Паралельно з рентгенівською, гама- і ЯМР-томографією розвивалися ультразвукова томографія. В наш час проводяться дослідження з використанням лазерного і синхротронного рентгенівського випромінювання [14].
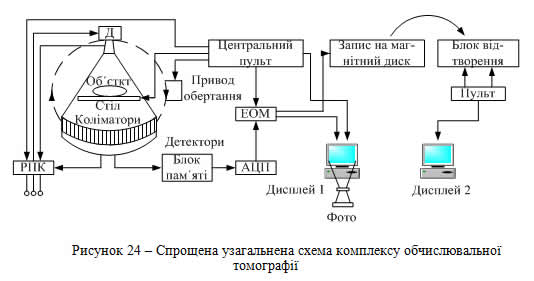
На рис. 23 наведено часову діаграму розвитку томографії і відповідних відкриттів та винаходів, на рис. 24 наведена спрощена узагальнена схема комп'ютерного томографа, на рис. 25 зображений зовнішній вигляд комп’ютерного томографа фірми СІМЕНС.
Як і в звичайному рентгенодіагностичному апараті тут є рентгенівський пристрій живлення (РПЖ) і випромінювач І. Але рівень стабілізації випромінювання в них на декілька порядків вищий. Імпульси рентгенівського випромінювання проходять через об’єкт дослідження і реєструються одночасно всіма детекторами лінійки, сигнали з яких надходять в блок пам’яті, а звідти – послідовно зчитуються аналого-цифровим перетворювачем АЦП і поступають в центральну ЕОМ для оброблення. Відновлене зображення записується для довгострокового збереження на магнітний диск, а для оперативної роботи – виводиться на екран дисплея. Магнітний диск містить всю інформацію про дослідження. На цьому може бути записане зображення декількох шарів (8 – 10) в залежності від задачі діагностики.
Як уже зазначалось, зображення, отримане за допомогою томографа, має дуже високу контрастну чутливість. Для оцінювання здатності томографа передавати малі зміни коефіцієнта ослаблення µ застосовано спеціальну величину Н, яка називається хаунсфілдом.
Один хаунсфілд – це 0,1% ослаблення води. Якщо прийняти µв за нуль і вести відлік в плюс і в мінус, то µ повітря складає приблизно мінус 1000 хаунсфілдів, а найбільш щільних кісток плюс 1000 хаунсфілдів. Послаблення всіх органів і тканин організму знаходиться в таких же межах.
Контрастна чутливість сучасних томографів складає для всього тіла 4 – 5 одиниць, для голови – до 2 одиниць. Діапазон градацій, що передаються, досягає ±1000 одиниць. Настільки велика кількість градацій не може бути відтворена одночасно на екрані сучасного дисплея, тому блок відтворення зображення дозволяє вибирати так звану «область інтересу», тобто зміщувати середнє значення яскравості від нульового значення в плюс чи в мінус в залежності від органа, що досліджується. Передбачається також можливість вибирати "ширину вікна", тобто межі відтворених на екрані дисплея даних. Природно, якщо межі обрані так, що діапазон даних перевищує можливості дисплея, зображення буде відтворено з меншою чутливістю.
Крім перерахованих можливостей оброблення зображення, у більшості систем передбачений цілий ряд додаткових маніпуляцій із зображенням, що розширює можливості його аналізу й інтерпретації.
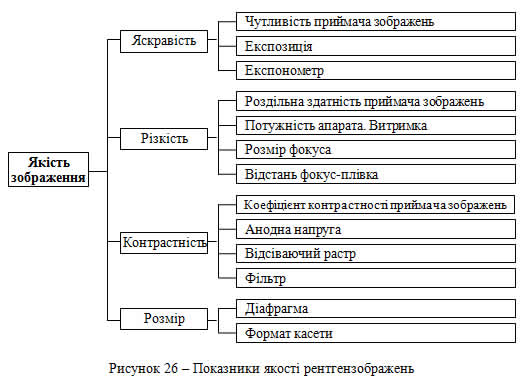
Рентгенівська діагностична апаратура дозволяє отримувати важливу інформацію про стан здоров'я людини. У середньому на кожні 200 чоловік щорічно припадає близько 100 рентгенівських досліджень, серед яких 161 знімок і 22 рентгеноскопії. Враховуючи високу питому вагу знімків цікаво визначити основні фізико-технічні аспекти, які впливають на якість зображення при рентгенографії (рис. 26).
На рис. 27 зображено рентгендіагностичний апарат фірми СІМЕНС
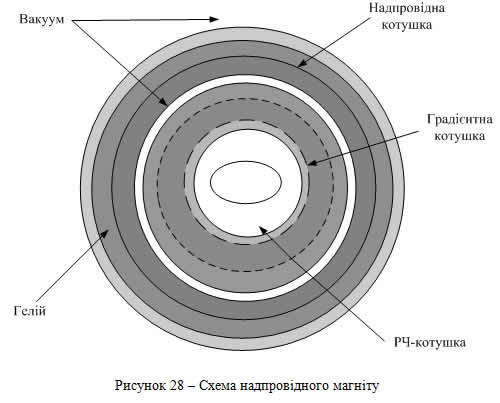
Магніт є найдорожчою частиною MP-томографа, що створює сильне стійке магнітне поле. Більшість сучасних магнітів, що випускаються різними виробниками, є надпровідними.
Всередині магніту розташовані градієнтні котушки, призначені для створення контрольованих змін головного магнітного поля В0 по осях X, Y і Z і просторової локалізації сигналу. Градієнтні котушки завдяки своїй конфігурації створюють керовану, однорідну й лінійну зміну поля в певному напрямку, мають високу ефективність, низьку індуктивність та опір [38].
Градієнтні котушки мають різні розміри, конфігурацію і бувають таких видів:
а) котушка у формі «8»;
б) котушка Голея, яка створює градієнти магнітного поля перпендикулярно до головного поля;
в) котушка Гельмгольца – пара котушок зі струмом, які створюють однорідне магнітне поле в центрі між ними;
г) котушка Максвелла, яка створює градієнти поля у напрямку головного магнітного поля;
д) здвоєна сідлоподібна котушка, яка створює градієнт у напрямку осей X та Y.
Для просторового збудження обраного об’єму використовуються три з’єднані ортогональні котушки, що створюють необхідні градієнтні поля, що додаються до головного поля (В0). Наприклад, при кодуванні сигналу для створення градієнта по осі Z може використовуватись пара Гельмгольца або котушка Максвелла, а по осях X та Y – парні сідлоподібні котушки. У ряді методів швидкого відображення градієнти також використовуються для створення зворотного імпульсу.
Використання цих котушок дозволяє зменшити число усереднень сигналу з високим співвідношенням сигнал/шум і роздільною здатністю, таким чином зменшуючи час сканування.
Сідлоподібна котушка являє собою дві петлі провідника, які огортають протилежні сторони циліндра, і використовується, коли статичне магнітне поле коаксіальне поздовжній (вздовж тіла) осі котушки.
Фазочутливим детектором є пристрій, що відокремлює сигнали ![]() ,
, ![]() від сигналу РЧ-котушки, перетворюючи лабораторну систему координат в обертову. Його основою є перетворювач частоти, що має два входи й один вихід. Якщо сигналами на вході є cos(A) і cos(B), то на виході одержують ½cos(A + В) і ½cos (А - В). Фазочутливий детектор звичайно складається із двох перетворювачів частоти, двох фільтрів, двох підсилювачів і 90°-ного перетворювача фази й має два входи й два виходи. На входи подаються частоти ν та ν0 і на виході одержують значення поперечної намагніченості Мх і Му. Аналого-цифровий перетворювач перетворює MP‑сигнал в цифровий, що обробляється за допомогою Фур'є-перетворення і відображається у вигляді зображення на моніторі.
від сигналу РЧ-котушки, перетворюючи лабораторну систему координат в обертову. Його основою є перетворювач частоти, що має два входи й один вихід. Якщо сигналами на вході є cos(A) і cos(B), то на виході одержують ½cos(A + В) і ½cos (А - В). Фазочутливий детектор звичайно складається із двох перетворювачів частоти, двох фільтрів, двох підсилювачів і 90°-ного перетворювача фази й має два входи й два виходи. На входи подаються частоти ν та ν0 і на виході одержують значення поперечної намагніченості Мх і Му. Аналого-цифровий перетворювач перетворює MP‑сигнал в цифровий, що обробляється за допомогою Фур'є-перетворення і відображається у вигляді зображення на моніторі.
У комп'ютері, який контролює всі компоненти томографа, можна виділити центральний блок оброблення, що складається із блока приймання і передавання даних, реконструкції зображень, зберігання даних і оперативної пам'яті, а також периферійні пристрої, до яких можна віднести блок зберігання даних і пристрою введення/виведення. Комп'ютер керує програматором градієнтів, що визначають вид і амплітуду кожного із трьох градієнтних полів, необхідних для одержання даних, а також обробленням даних для відображення зображень. Градієнтний підсилювач збільшує потужність градієнтних імпульсів до рівня, достатнього для керування градієнтними котушками. Джерело РЧ-імпульсів (генерує синусоїду потрібної частоти) і програматор імпульсів (надає їм форму sinc імпульсів) є РЧ-компонентами, що перебувають під контролем комп'ютера. РЧ-підсилювач збільшує потужність імпульсів від міліват до кіловат. Вибір і модифікація послідовності, що відображає введення даних у комп'ютер здійснюються через консоль керування.
Пацієнт розташовується на керованому комп'ютером столі, точність установлення позиції якого становить 1 мм.
В процедурній кімнаті сканування по периметру розташований електрично провідний екран (мідна сітка або листи алюмінію) – клітка Фарадея, що зменшує вплив зовнішніх радіохвиль на роботу томографа і запобігає виходу РЧ-хвиль за межі процедурної кімнати. Екранування кімнати може бути повним (з 6 сторін) або частковим, якщо межі поля потрібно зменшити лише в деяких областях.
11.1 Магніторезонанса томографія
Магніто-резонансна томографія (МРТ) – метод відображення, що використовується в основному для отримання високоякісних зображень органів людського тіла. МРТ грунтується на принципах ядерно-магнітного резонансу (ЯМР) і методі спектроскопії, що використовується вченими для отримання даних про хімічні та фізичні властивості молекул.
Суть методу: магнітний резонанс – фізичне явище, яке грунтується на властивостях деяких атомних ядер при розміщенні їх в магнітному полі поглинати енергію в радіочастотному діапазоні і випромінювати її після припинення дії радіочастотного імпульсу. При цьому напруга магнітного поля і частота радіочастотного магнітного поля повинні чітко відповідати одне одному, що і називається ядерним магнітним резонансом: ядерним – оскільки взаємодія відбувається лише з магнітними моментами атомних ядер, магнітним – оскільки ці моменти орієнтовані постійним магнітним полем, а зміна їх орієнтації викликається радіочастотним магнітним полем, резонансом – оскільки параметри цих полів чітко пов'язані між собою. Найбільш цікавими для медицини є ядра 1Н, 13С, 23Na, 31Р, оскільки всі вони присутні в тілі людини. Характер інтенсивності сигналу в МРТ визначається в основному чотирма параметрами: протонною щільністю (кількістю протонів в досліджуваній тканині), часом спін-граткової релаксації (ТІ), часом спін-спінової релаксації (Т2), рухом чи дифузією досліджуваних структур. Для МРТ розроблені різні імпульсні послідовності, які, залежно від мети, визначають вклад того чи іншого параметра в інтенсивність зображення досліджуваних структур для отримання оптимального контрасту між нормальними та зміненими тканинами.
Залежно від напруженості магнітного поля всі MP-томографи зазвичай класифікують на наднизькопольові (менше 0,1 Тл), низькопольові (0,1 – 0,4 Тл), середньопольові (0,5 Тл), високопольові (1 – 2 Тл), надвисокопольові (більше 2 Тл). Прилади з полем до 0,3 Тл зазвичай мають резистивні чи перманентні магніти, вище 0,3 Тл – надпровідні.
Більше 70 % парка MP-томографів складають моделі з надпровідними магнітами (0,5 – 1,5 Тл).
Магніто-резонансна томографія грунтується на поглинанні та пропусканні енергії в радіочастотному діапазоні електромагнітного спектра. МРТ дозволяє побачити об'єкт, за розмірами менший, ніж довжина хвилі випромінювання, використаного для отримання зображення. МРТ долає це обмеження за рахунок отримання зображень, які базуються на просторових варіаціях фази і частоти радіочастотної енергії, поглиненої і пропущеної відбиваючим об'єктом.
11.2 Спіральна комп’ютерна томографія
Впровадження спіральної технології сканування не лише покращило якість візуалізації, але й відкрило зовсім нові напрямки (найбільш значимими з них є КТ-ангіографія, високоякісна тривимірна візуалізація і віртуальна ендоскопія).
Спіральне сканування полягає в одночасному виконанні двох процедур: безперервного обертання рентгенівської трубки навколо об'єкта і безперервного поступального руху стола з пацієнтом (траєкторія пучка рентгенівських променів, спроектована на пацієнта, набуває форму спіралі).
До основних переваг спіральної КТ відносяться:
- економія часу і покращення якості обслуговування хворих;
- збільшення пропускної спроможності;
- зменшення променевого навантаження. Збільшення кроку спіралі при однаковому часі дослідження дозволяє збільшити зону сканування, зменшуючи тим самим дозу опромінення. При кроці спіралі 1,5 доза опромінення пацієнта приблизно на одну третину менша дози, отриманої ним при традиційному скануванні суміжних шарів;
- зменшення спотворень, обумовлених рухами пацієнта. Оскільки при спіральній КТ сканування можна провести за один час затримки дихання, спотворення, пов'язані з дихальними рухами пацієнта, мінімальні;
- висока точність реконструйованих зображень. Отриманий при спіральній КТ безперервний об'єм даних дозволяє здійснити тривимірну і мультипланарну реконструкцію з великою точністю. При проведенні мультипланарної реконструкції зображень артефакти практично не виявляються. Результати КТ-досліджень стають більш наочними, демонстративними, доступними. Високоінформативні багатосмугові реформації усунули обмеження діагностичних зображень лише аксіальною проекцією і максимально зблизили можливості КТ і магніто-резонансної томографії;
- ретроспективна реконструкція. В складних для діагностики випадках доцільно зберігати дані, отримані при спіральному скануванні. Тоді при утрудненнях в поставленні діагнозу може бути проведена ретроспективна реконструкція зображень зі зміною параметрів реконструкції, зокрема з перекриванням шарів. При цьому немає необхідності викликати пацієнта для повторного сканування;
- покращення детектування невеликих патологічних утворень. Спіральна КТ дозволяє здійснити реконструкцію зображень при довільних інтервалах і товщині шару, а також з перекриванням шарів. Це дає можливість виявляти патологічні зміни малих розмірів, невидимі чи недостатньо чітко видимі при традиційній КТ;
- віртуальна ендоскопія. Дані спіральної КТ можуть бути подані у вигляді «подорожі» всередині і навколо порожнистих анатомічних структур, заповнених повітрям, кров'ю або будь-якою іншою речовиною;
- сканування при оптимальному контрастуванні. Достатній ступінь контрастування судинних структур при повному скануванні грудної клітки, черевної порожнини і таза може бути досягнутий при використанні невеликих кількостей контрастної речовини;
- економічна ефективність КТ пов'язана з її діагностичною ефективністю. Швидкість роботи, інформативність і об'єктивність отриманих при спіральній КТ даних дозволяють здійснювати швидке поставлення діагнозу і, відповідно, ефективне лікування. Крім того, сучасні інформаційні технології дають можливість, передаючи зображення по мережі на інші комп'ютери, оперативно отримувати консультації інших спеціалістів.
Історія застосування ультразвукових коливань в медицині в діагностичних цілях нараховує близько п’яти десятиріч. Порівняно невисока вартість досліджень та обладнання, неінвазивний характер досліджень, високі показники просторової та часової роздільної здатності дозволили ультразвуковому дослідженню стати одним із основних методів функціональної діагностики.
Серед множини акустичних параметрів, які могли б використовуватись як критерії відмінності здорової тканини від ураженої найчастіше використовується коефіцієнт затухання акустичних коливань і коефіцієнт зворотного розсіювання.
Теоретична модель процесу зворотного розсіювання ультразвукового випромінювання включає в себе вхідний сигнал моделі, що є енергетичним спектром коливань, які випромінюються ультразвуковим перетворювачем Wt(f), а вихідний – енергетичним спектром зворотно-розсіяного ультразвукового випромінювання від досліджуваного органа Wr(f).
Функція перетворення сигналу має вигляд:
де f – частота випромінювання.
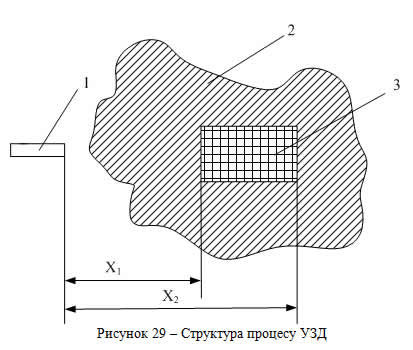
На рис. 29 наведена схема розташування ультразвукового перетворювача при дослідженні печінки, на якій 1 – ультразвуковий перетворювач; 2 – тканина печінки; 3 – досліджувана ділянка.
Якщо глибина розміщення досліджуваної ділянки змінюється від Х1 до Х2, то коефіцієнт затухання визначається формулою:
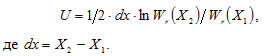
Таким чином, для визначення коефіцієнта затухання необхідно отримати енергетичний спектр зворотного розсіювання при двох різних глибинах.
В наш час на ринку представлені два види ультразвукових сканерів – портативні та стаціонарні. В залежності від області медичного застосування УЗ сканери поділяють на універсальні та спеціалізовані.
До спеціалізованих відносять прилади: для внутрішньосудинних, транскраніальних (ехоенцефалоскопи) досліджень, офтальмологічні (ехоофтальмометри), фетальні монітори та ін. Однак частіше застосовуються універсальні прилади.
Залежно від використовуваних в них режимів можна виділити три основні типи приладів: чорно-білі – для отримання двовимірних чорно-білих акустичних зображень, режими роботи: В, М, В + В, В + М; сканери зі спектральним доплером, що дозволяє додатково отримувати характеристики кровотоку, режими роботи: В, М, PW або CW (рідше), В + В, В + М, B + PW(CW) – дуплексні; сканери з кольоровим доплерівським картуванням – найбільш досконалий тип ультразвукових приладів з можливістю відображення двовимірного розподілу швидкостей кровотоку, що виділяються кольором на двовимірному сірошкальному зображенні тканин основні режими роботи: В, М, PW і CW, CFM, В + В, В + М, B + PW(CW), B + PW(CW) + CFM – триплексні.
Сьогодні підвищеним попитом користуються УЗ сканери високого класу з цифровим формувачем променя і цифровим приймачем. Цифрові сканери мають переваги перед сканерами з аналоговою побудовою формувача променя та приймача: плавне, практично безперервне динамічне фокусування на приймання і більш гнучке керування режимами роботи.
При роботі в А-режимі відбиті сигнали зображаються у вигляді піків, при цьому можна виміряти відстань між двома різними структурами. В В-режимі (2D‑режим) всі тканини, через які проходить ультразвуковий промінь, відображаються на екрані. Отримані двовимірні зображення називають зрізами в В-режимі. При швидкому чередуванні В-зрізів отримується відеомоніторне спостереження. М-режим – ще один спосіб відображення інформації. В результаті отримується хвиляста лінія. Цей режим використовується в кардіології (зазвичай разом з В-режимом).
Режим відеомоніторного спостереження дає чередування зображень різних частин тіла, розташованих під датчиком в тому порядку, в якому здійснювалось сканування. Зображення змінюється при будь-якій зміні положення тіла. Рухи відображаються на моніторі в реальному масштабі часу.
Кольорове доплерівське картування (CDF1, CFM, CD, CF1, CDV, CF та ін.) полягає в тому, що розподіл та напрямок руху потоків подані в двовимірному зображенні, при цьому пізні швидкості кодуються різним кольором.
Для тривимірного зображення (3D, volume mode) необхідно отримати інформацію про досліджувані тканини за трьома просторовими координатами. Для цього застосовують технологію В-сканування з метою отримання двовимірного зображення плоского шару і забезпечують можливість переміщення площини сканування по третій просторовій координаті.
Комплектуючи УЗ сканер, необхідно врахувати, що на практиці зазвичай потрібно не більше 3-4 датчиків. В основному використовується п'ять типів: механічні, секторні, лінійні, конвексні і з фазованим скануванням. Вони розрізняються за методом формування ультразвукових коливань, методом випромінювання та створюваним ними форматом зображення на екрані монітора.
З діагностичною метою зазвичай використовують датчики з частотами: 3,0 МГц, 3,5 МГц, 5,0 МГц, 6,5 МГц, 7,5 МГц. Крім того, в останні роки з'явились прилади, обладнані високочастотними датчиками 10 – 20 МГц.
Існує велика різноманітність внутрішньосмугових датчиків, які застосовуються в різних областях. Однак вважається, що найкращий датчик для загальної практики – конвексний з робочою частотою 3,5 МГц (для дорослих) та 5 МГц (для педіатрії), рідше – 2 МГц (для глибокого розташування органів). Довжина дуги робочої поверхні – 36 – 72 мм, кут огляду – 40 – 90°.
В сучасних приладах все більше застосування знаходять широкосмугові датчики. Якщо в звичайних відносна ширина смуги робочих частот рівна ∆f / f0 ≈ 0,4 – 0,5, де ∆f– ширина смуги частот, f0– центральна (номінальна) частота, то в широкосмугових датчиках відносна ширина смуги може перевищувати одиницю. Це призводить до суттєвого покращення роздільної здатності.
СоноКТ – технологія складноскладової ультразвукової (УЗ) комп'ютер-ної томографії (КТ) в реальному масштабі часу. Вона є новим методом отримання і оброблення інформації для отримання надінфоративного зображення. Ідея СоноКТ – отримати серію вихідних зображень об'єкта під різними кутами зору і за допомогою комп'ютерної реконструкції об'єднати їх в одне. В результаті такого комп'ютерного синтезу долається бар'єр традиційного ортогонального УЗ сканування – велика кількість перешкод через прямолінійний хід УЗ променя в глибину тканини і назад.
Найвища якість зображення досягається складанням до дев'яти окремих УЗ зображень, отриманих за декількома напрямками УЗ променя в одній і тій же площині без зсуву датчика рукою лікаря, а лише виключно за допомогою цифрового керування ходом променя. Відбувається комбінування простих зображень в одне складне при збереженні частоти кадрів сканування в реальному часі.
Отримуються, таким чином, зображення виключного ступеня деталізації, з чіткою візуалізацією меж розділу тканин при одночасному усуненні артефактів, що забезпечує підвищення точності і достовірності діагностики.
СоноКТ-візуалізація дає можливість лікарю досягнути на новому технологічному рівні постійної якості зображення, що підвищує ефективність роботи.
Друге покоління СоноКТ включає технології:
- широкий діапазон лінійних і конвексних датчиків;
- розширений спектр клінічного застосування;
- панорамне сканування до 1 м;
- об'ємна реконструкція найвищої деталізації.
Друге покоління СоноКТ забезпечує досягнення принципово нового рівня діагностичних можливостей шляхом поєднання технологій комбінованої візуалізації реального масштабу часу, гармонічної тканинної, панорамної візуалізації і 3D УЗД.
СоноКТ-візуалізація використовує комп'ютерну технологію керування ультразвуковими променями для презиційного маневрування ними «поза віссю» з метою отримання до дев'яти кутів огляду під час одного сканування.
11.4 Ендоскопічна ультрасонографія
Потенціальні можливості ендоскопічної ультрасонографії (ЕндоУЗД) розширяються у зв'язку з удосконаленням клінічних досліджень і прогресом у виробництві обладнання. Особливої уваги заслуговує розроблення високоякісних мініатюрних датчиків, які можуть бути проведені через допоміжні канали стандартних ендоскопів.
Основним принципом ЕндоУЗД є збільшення чіткості і деталізації зображення паралельно зі зменшенням глибини сканування в міру підвищення частоти використовуваного ехосигналу. Нові мікродатчики з робочою частотою 12 і 20 МГц, а найновіші – 30 МГц, забезпечують унікальні за своїми об'єктивними характеристиками результати візуалізації стінки травного тракту, від стравоходу до прямої кишки.
Можливість отримати зображення окремих шарів стінки органа в послідовності, яка відповідає її гістологічній будові, а не як єдиний утвір, являє собою потужний засіб клінічного дослідження і є основою для багатьох показань для проведення ЕндоУЗД. Найновіші мікродатчики можуть бути використані для діагностики підслизових утворень, аномальних складок, варикозного розширення вен стравоходу і визначення стадії злоякісного пухлинного процесу. Датчики нового покоління, керовані по проводах, можна вводити в панкреатичні і жовчні протоки для діагностики пухлинних процесів і конкрементів. Інші показання до проведення стандартного ЕндоУЗД пов'язані з можливостями методу забезпечувати високо-деталізовані результати візуалізації ділянок, розташованих в безпосередній близькості від травного тракту. Продовжується створення та удосконалення радіальних механічних пристосувань і електронного лінійного інструментарію.
Другим суттєвим нововведенням, яке увійшло в клінічну практику, є колоноскопи зі змінною гнучкістю. Обладнання такого роду перспективне в плані забезпечення більш повного дослідження при більш комфортних умовах для пацієнта.
До останніх технологічних новинок, що розширюють область застосування гнучких ендоскопів, можна віднести зменшення їх зовнішнього діаметра до 2 мм і менше, флуоресцентні методики, пристрій «ендоскоп в ендоскопі», ультразвуковий датчик в ендоскопі. Удосконалення дозволяють за допомогою ендоскопів проникати у важкодоступні місця, проводити діагностику на якісно новому рівні.
Окремо варто відмітити розробку ендоскопічних систем відеоспостереження. Це відкриття дає доступ до ендоскопічних зображень широкому колу медичних спеціалістів. Завдяки електронному обробленню даних з'явилась можливість роздрукувати кольорові зображення, передавати їх по локальній мережі медзакладу і транслювати на медичних телеконференціях в Інтернеті.
Ендоскопічна оптична когерентна томографія – новий метод медичної діагностичної візуалізації, який проходить стадію клінічних досліджень. Метод подібний до ЕндоУЗД, однак передбачає використання замість ультразвуку інфрачервоних променів, що дає можливість в десятки разів збільшити роздільну здатність зображення. При цьому відбитий від візуалізованого об'єкта потік променів реєструється і аналізується методом інтерферометрії.
В цілому, можна виділити три основні тенденції в розвитку сучасної ендоскопії. По-перше, ендоскопія стає більш доступним, зручним і менш дорогим методом дослідження. Технологічні досягнення, в свою чергу, також сприяють удосконаленню точності діагностики. По-друге, в міру подальшого розвитку ендоскопічної хірургії, як, наприклад, створення «гнучких методик», будуть все більше стирати межі між традиційною ендоскопією та хірургією. Третя тенденція пов'язана з удосконаленням рівня практичної підготовки і підвищенням відповідальності спеціалістів.
Літотриптори – це клас медичних приладів, призначений для дроблення каменів у нирках, жовчному міхурі, слинних протоках. Визначення місцеположення каменя і безперервний лікарський контроль в процесі літотрипсії відбувається за допомогою двох ультразвукових В-сканерів реального часу, які вмонтовані в датчик системи. Обидва сканери повертаються на 90° для виконання секційного сканування в повздовжньому і поперечному напрямках. Діапазон глибини сканування складає, як правило, 40-180 мм. За допомогою пристрою наведення система датчик-сканер може пересуватися в трьох напрямках – повздовжньому, поперечному і вертикальному.
Тепловізійна апаратура. В 1954 році Дж. Д. Харді довів, що шкіра людини повністю поглинає падаючі на неї інфрачервоні промені і має здатність до інфрачервоного випромінювання. Прилади, які реєструють таке випромінювання, отримали назву тепловізори.
В тепловізорах інфрачервоне випромінювання шкіри сприймається оптичною системою камери, яка проводить розгортку поля зору і фокусує випромінювання на детекторі (приймачі), який є основним елементом тепловізора. Для пригнічення напівпровідникових шумів детектор охолоджується рідким азотом до температури мінус 196 °С.
Під дією інфрачервоних променів детектор змінює свій опір і в електричному колі, до якого входить фоторезистор, виникають електричні сигнали, які залежать від інфрачервоного потоку. Після підсилення ці сигнали регулюють інтенсивність електронного пучка в трубці телевізійного монітора, на якому з’являється теплова картина досліджуваної ділянки тіла, де світліші ділянки відповідають поверхні тіла з підвищеною температурою.
Тепловізори можуть вимірювати і абсолютні значення температури. Індикаторний блок здійснює реєстрацію двох ізотермічних функцій, яка відбувається як одночасно, так і послідовно.
В останні роки з’явилися тепловізори кольорового зображення, які дають більш інформативне зображення досліджуваної поверхні тіла людини. Сучасна тепловізійна техніка дозволяє об’єктивно, наочно і швидко реєструвати температуру цілих областей і всього тіла на електрохімічному носії чи папері.
Одержуване зображення і можливості виділення класифікаційних ознак захворювання залишають бажати кращого. Тому дуже актуальною є задача підвищення якості оброблення термограм, автоматизації їхньої розшифровки, поліпшення тепловізійної діагностики. Розв’язання цих задач пов’язано з застосуванням обчислювальної техніки, що дозволяє впровадити перспективний метод мультимедійної термографії. Цей метод заснований на виділенні зрізів теплового поля за значенням температури кожного з них, у результаті виконання якого виходить динамічна картина теплового поля. Маючи таку можливість спостерігати динамічну картину розподілу температурних градієнтів, лікар може швидше і точніше установити діагноз захворювання.
Для цих термографних комп’ютерних комплексів розроблене сучасне програмне забезпечення. Так, наприклад, програмне забезпечення комплексу SIT-INFRA, з огляду на специфіку термодіагностичних досліджень, разом з математичним обробленням зображень (фільтрація, побудови тривимірних термопрофілів, масштабування зон інтересу) дозволяє після одержання термограми створити картку пацієнта, роздрукувати її і зберегти в архіві на жорсткому диску. Електронний архів розрахований на збереження 20000 термограм і карток пацієнта. Для спостереження за динамікою процесів передбачений перегляд декількох знімків з архіву.
Контрольні запитання:
1. В чому різниця між томографією і рентгенографією?
2. Що таке МРТ?
3. Якими показниками якості характеризується рентгенологічна апаратура?
4. В чому полягає метод ультразвукової діагностики?
5. Які види полів, випромінюваних біооб’єктом використовуються в тепловізійній діагностиці?
6. Поясніть принцип роботи комп'ютерного томографа.
7. В чому полягають переваги спіральної КТ ?
8. Що являє собою надпровідний магніт томографа?
9. Які режими роботи УЗ-сканерів ви знаєте?
10. Поясніть принципи роботи СоноКТ ?
11. Поясніть роботу ультразвукового ендоскопа.