1.2.3 Загальна характеристика ковалентного зв’язку
До основних характеристик хімічного зв’язку належать: Довжина зв’язку – це відстань між ядрами атомів, які його утвори-ли. Довжину зв’язків С–С та С–Н в молекулах органічних сполук наведено, відповідно, в табл. 1.7 – 1.9.
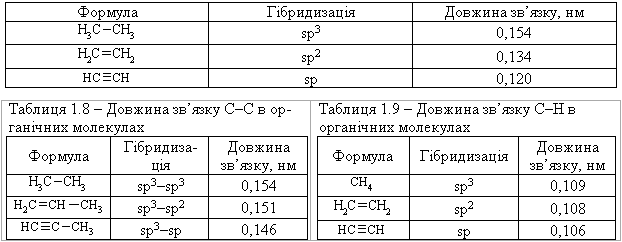 Дані таблиць 1.7 та 1.8 свідчать, що із зміною гібридизації атома Ка-рбону (збільшення внеску s-орбіталі) закономірно зменшується довжина зв’язку. Дані, які наведені в табл. 1.7 – 1.9 можна прокоментувати наступ-ним чином:
– довжина зв’язку не є незмінною (сталою) величиною і залежить від конкретного хімічного оточення; Енергія зв’язку – це енергія, яку потрібно затратити на те, щоб ро-зірвати даний хімічний зв’язок. Така ж енергія виділяється при утворенні цього зв’язку між атомами. Енергію деяких хімічних зв’язків наведено в табл. 1.10. Нведені в табл. 1.10 дані свідчать, що із збільшенням кратності зв’язку, його енергія закономірно зростає. 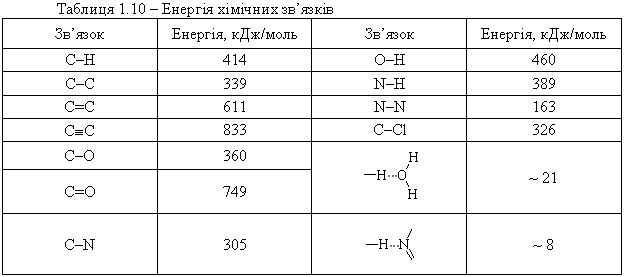
Полярність зв’язку обумовлена зміщенням загальної електронної па-ри хімічного зв’язку до більш електронегативного атома. Кількісно поля-рність хімічного зв’язку визначається дипольним моментом, який обчис-люється за формулою: = q l, де - дипольний момент, одиниця виміру дебай (D), 1 D = 3,3410-30 Клм; q – заряд, Кл; l – довжина зв’язку, м.  Поляризованість зв’язку обумовлена легкістю зміщення (деформу-вання) електронної густини зв’язку під дією зовнішніх чинників (розчинни-ків, каталізаторів, реагенів). Ця характеристика хімічного зв’язку може бути кількісно виражена молекулярною рефракцією – RD. Рефракцію хімі-чного зв’язку можна легко розрахувати, виходячи із рефракцій окремих атомів (RС = 2,418; RН = 1,100 і т.д.) Так, RС=С = 4,15, тоді як RСС = 6,03. Поляризованість, в першу чергу, залежить від розмірів та рухливості елек-тронних хмар, тому -зв’язок, виходячи із цього, буде більше поляризува-тись, ніж -зв’язок. Можна стверджувати, що поляризованість прямо про-порційна реакційній здатності органічних молекул.
Питання для самоконтролю 1. Навести схеми утворення σ- і π-зв’язків у молекулах вуглеводнів. Порівняти міцність σ- і π-зв’язків. Пояснити, чому їх міцність неоднакова. 2. Порівняти електронну будову простих і подвійних зв’язків. Як утво-рюються σ- і π-зв’язки? Які типи реакцій характерні для вуглеводнів, що мають тільки σ-зв’язки? 3. Пояснити в якому гібридному стані перебувають атоми Карбону в таких сполуках: 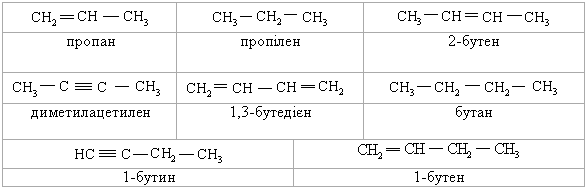
Розглянути цей стан для пропану. 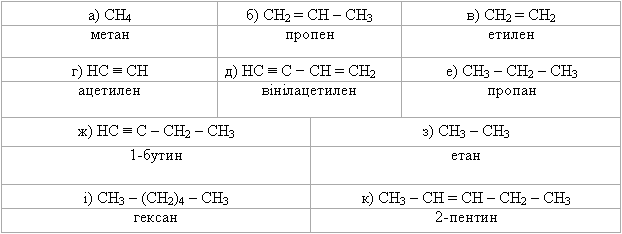
Визначити скільки σ- і π-зв’язків є в кожній сполуці. 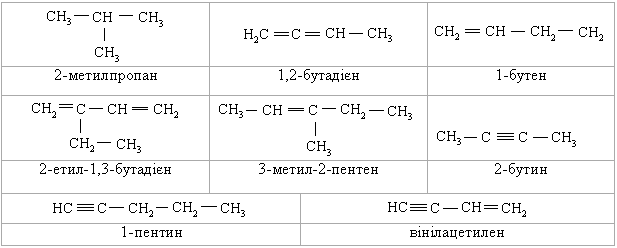
Дати визначення σ- і π-зв’язкам. 7. Пояснити будову атома Карбону. Дати визначення поняттям: хви-льова функція, атомна орбіталь. Навести характеристики атомних орбіта-лей. 8. Пояснити правила утворення молекулярних орбіталей із атомних: залежність між довжиною та енергією С–С σ-зв’язків від типу гібридизації атома Карбону. 9. Охарактеризувати природу хімічних зв’язків в органічних сполу-ках. Пояснити будову атома Карбону в основному та збудженому станах. Сформулювати принцип Паулі та правило Гунда. 10. Сформулювати основні положення теорії МО ЛКАО та правила утворення молекулярних орбіталей із атомних орбіталей. Пояснити енер-гетичну діаграму утворення молекули водню.
Самостійна робота 1. Збірник тестових завдань з органічної хімії / Під ред. проф. Рансько-го А. П. – Дніпропетровськ, 2007. – С. 20-32. – ISBN 966-8018-54-0. Основна література 1. Гауптман З. Органическая химия / Гауптман З., Грефе Ю., Ремане Х. – М.: Химия, 1979. – С. 50-81. 2. Ластухін Ю. О. Органічна хімія / Ю. О. Ластухін, С. А. Воронов. – Львів: Центр Європи, 2001. – С. 27-67. – ISBN 966-7022-19-6. 3. Черных В. П. Лекции по органической химии / В. П. Черных. – Харьков: Золотые страницы, 2005. – С. 13-32. – ISBN 966-615-155-3. Додаткова література 1. Грандберг И. И. Органическая химия / Грандберг И. И. – М.: Высшая школа, 1987. – С. 25-48. 2. Моррисон Р. Органическая химия / Моррисон Р., Бойд Р. – М.: Мир, 1974. – С. 11-31. 3. Э. Картеля. Валентность и строение молекул / Э. Картеля, Т. В. А. Фо-улс – М.: Химия, 1979. – С. 115-116. |