1.2.2 Гібридизація атомних орбіталей Розглянемо будову атому Карбону в основному та збудженому стані (рис.1.5): 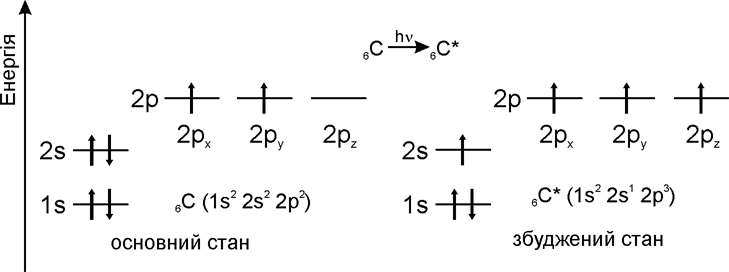 При збудженні основного стану атома Карбону відбувається перехід одного електрона з 2s-підрівня на 2р-підрівень (2pz) з утворенням збудже-ного атома Карбону з чотирма неспареними електронами. Відомо, що в більшості органічних сполук атом Карбону чотирива-лентний і що в симетричній молекулі метану (СН4) всі чотири зв’язки рів-ноцінні. Для пояснення цього факту в органічній хімії було введено по-няття про гібридизацію атомних орбіталей (Л. Полінг, Д. Слейтер, 1927-1934 рр.). Гібридизація – це перекривання (перемішування) різних за природою атомних орбіталей (s, p) з утворенням гібридних атомних орбіталей. – в гібридизації беруть участь атомні орбіталі, близькі за енергією та симетрією; – гібридизовані атомні орбіталі беруть участь в утворенні лише σ-зв’язків, які завдяки ефективному перекриванню з іншими атомними орбі-талями, утворюють міцні ковалентні зв’язки. Атом Карбону в органічних сполуках може існувати в трьох валент-них станах: – перший валентний стан (sp3-гібридизація) характерний для алканів (насичених вуглеводнів); – другий валентний стан (sp2-гібридизація) характерний для алкенів (ненасичених вуглеводнів); – третій валентний стан (sp-гібридизація) характерний для алкінів (ненасичених вуглеводнів).  Графічно це можна показати так: 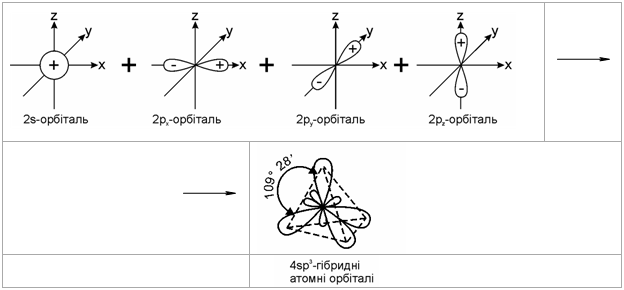 Атом Карбону в sp3-гібридному стані знаходиться в центрі правиль-ного тетраедра з валентним кутом 109 ° 28. 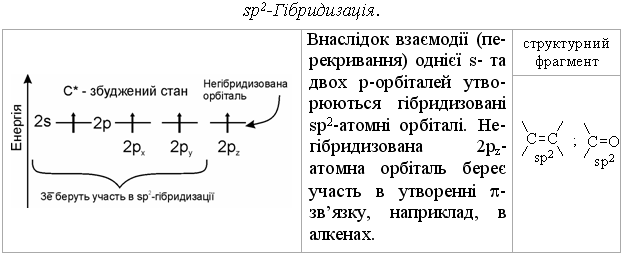 Графічно утворення sp2-атомних гібридних орбіталей можна показати на-ступним чином: 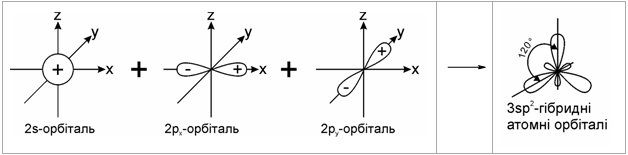 Утворені sp2- гібридні атомні орбіталі є тригональними (площинний три-кутник) з валентним кутом 120 °.  Графічно утворення sp-атомних гібридних орбіталей можна показати на-ступним чином: 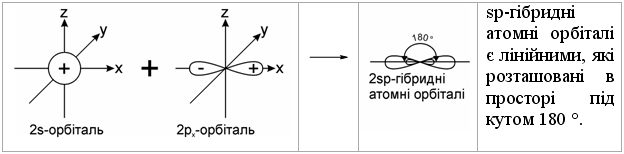 Аналізуючи валентні стани атома Карбону в різних вуглеводнях, можна констатувати, що при переході в ряду sp3-, sp2-, sp-гібридних орбі-талей атома Карбону частка s-орбіталі (її внесок в загальну гібридну орбі-таль) та електронегативність атома Карбону закономірно зростають, що суттєво впливає на хімічні властивості цих сполук в ряду алкани – алкени (ethylenes) – алкіни (acetylene), табл. 1.6.
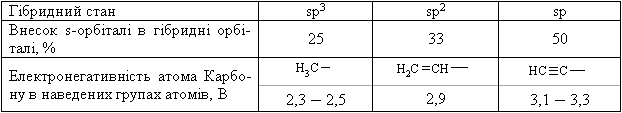 |