1.2 ХІМІЧНИЙ ЗВ’ЯЗОК В ОРГАНІЧНИХ СПОЛУКАХ 1.2.1 Загальні положення утворення хімічного зв’язку Хімічний зв’язок в молекулах можна розглядати як взаємодію вален-тних (зовнішніх) електронів та ядер атомів (ядерно-електронна взаємо-дія), в результаті якої виділяється енергія хімічного зв’язку та утворю-ється стабільний молекулярний остов. Механізм утворення хімічного зв’язку можна розглянути на прикладі молекули Н2. Врахуємо, що до одного нерухомого атома в будь-якій точці простору наближається другий атом (рис. 1.2).
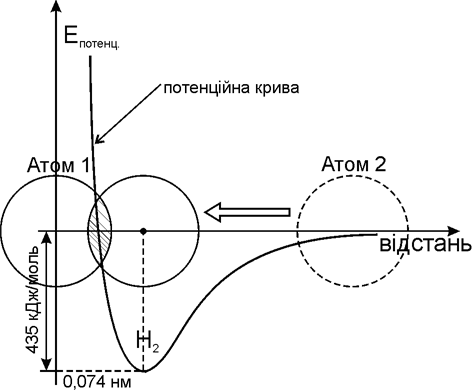 Рисунок 1.2 – Зміна потенційної енергії (потенційна крива) в процесі утворення 2-х атомної молекули водню Н2 При цьому, на відповідній відстані в результаті взаємодії валентних елект-ронів звільняється енергія хімічного зв’язку, а між двома атомами виника-ють сили притягування (сили хімічної взаємодії). Але, починаючи з певної відстані між позитивно зарядженими ядрами атомів зростають сили від-штовхування.Тому потенційна енергія Епот., як векторна сума сил притягу-вання та відштовхування, спочатку (при зближенні ядер) плавно падає, проходячи через мінімум, а потім різко зростає. Таким чином, є така від-стань між атомами (у випадку молекули Н2 це 0,074 нм), якій відповідає максимум виділеної хімічної енергії та мінімум потенційної енергії Епот. (у випадку молекули Н2 це 435 кДж/моль). Розглянутий механізм утворення хімічного зв’язку в молекулі Н2 характерний для більшості органічних мо-лекул. Для зображення хімічного зв’язку в молекулі водню (Н2), з враху-ванням теорії квантової механіки, використовують два основних методи – метод валентних зв’язків (МВЗ) (рис. 1.3) та метод молекулярних орбіта-лей (МО) (рис. 1.4). 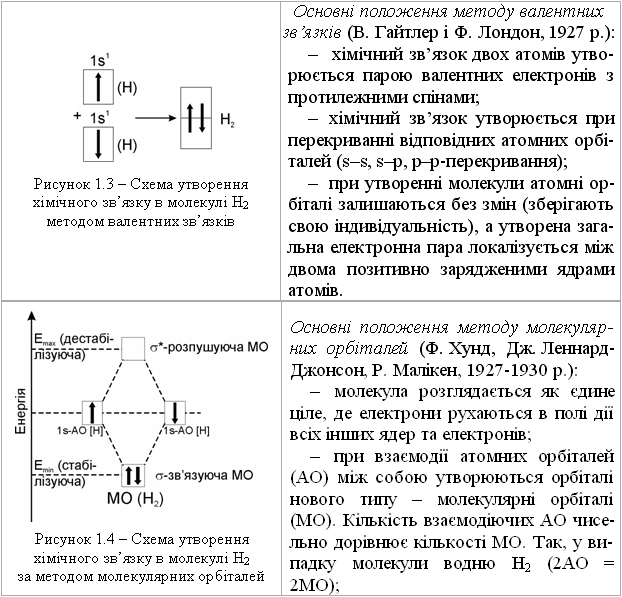 – одна із утворених молекулярних орбіталей називається зв’язуючою, позначається ( - або -) і має меншу енергію, ніж відповідна АО, друга МО називається розпушуючою, позначається (*- або *-) і має більшу енергію, порівняно із відповідною АО; – порядок заповнення (зростання енергії) молекулярних орбіталей та-кий: 1s < *1s < 2s < *2s < 2p < y2p = z2p < 2p = 2p < *2р. Основи „електронної теорії валентності” належать В. Косселю та Дж. Н. Льюїсу (1916 р.), згідно з якою: – атоми, які утворюють хімічний зв’язок, прагнуть до електронної кон-фігурації інертних газів; – атоми, які утворюють загальну електронну пару, віддають або при-ймають електрони. Принцип заповнення зовнішніх оболонок до конфігу-рації інертних газів при утворенні хімічного зв’язку називається правилом „октета” (октетним правилом). Необхідно відмітити, що В. Коссель, який вивчав полярні молекули, пояснив утворення йонного зв’язку в полярних молекулах (NaCl, CaCl2), а Дж. Н. Льюїс пояснив утворення хімічного зв’язку у неполярних молекулах (H2, N2, O2). Термін „ковалентний зв’язок” ввів Ленгмюр у 1919 році (доповнена теорія Льюїса-Ленгмюра). Крім відмічених основних типів хімічного зв’язку: йонного та кова-лентного, ще розрізняють донорно-акцепторний (координаційний) зв’язок, водневий (hydrogen bond) та металічний. Приклади основних типів хіміч-ного зв’язку в різних молекулах наведено в табл. 1.5. 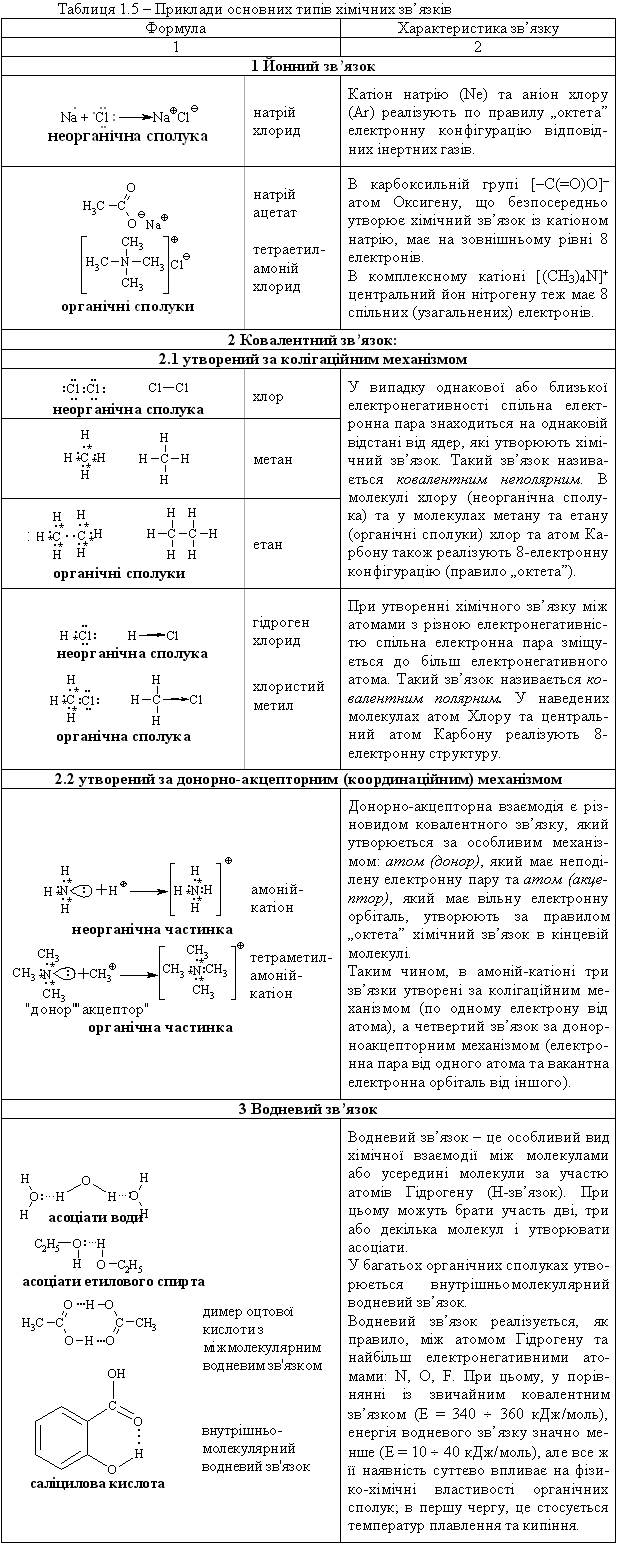 |