1.3.2 Класифікація органічних реакцій за типом розриву хімічних зв’язків Реакції гомолітичного (радикального) розриву хімічного зв’язку (го-моліз) супроводжуються утворенням вільних радикалів: 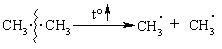 Вільний радикал – це незаряджена частинка, яка має неспарений еле-ктрон (одноелектронну атомну орбіталь): 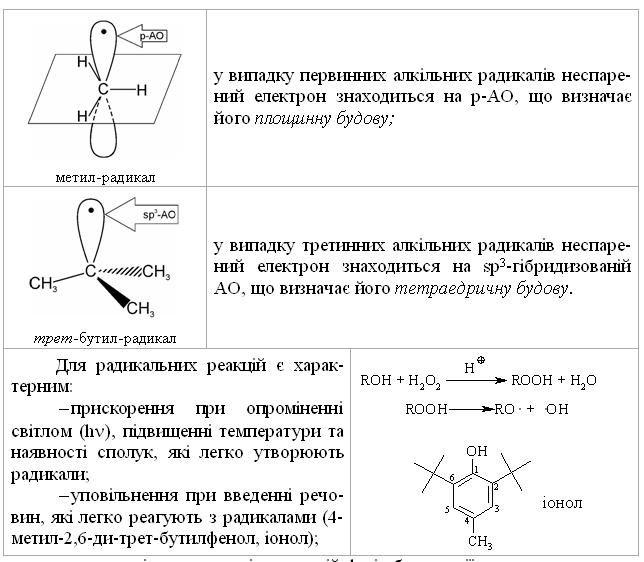 – взаємодія компонентів у газовій фазі або при дії неполярних апро-тонних розчинників (ТГФ – тетрагідрофуран); – ланцюгово-радикальний механізм прискорення, при якому один ініціатор може викликати безмежну низку хімічних перетворень; – висока залежність хімічних перетворень від просторових ефектів. Реакції гетеролітичного (йонного) розриву хімічного зв’язку (гете-роліз) супроводжуються утворенням йонів: 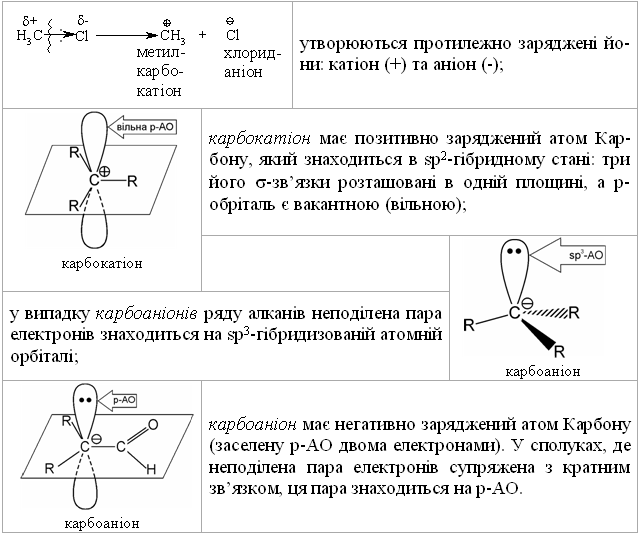 Для гетеролітичних реакцій є характерним: – прискорення в присутності кислот або основ (кислотно-основний каталіз); – проходження взаємодії в розчинах; – відсутність впливу акцепторів (інгібіторів) вільних радикалів на швидкість реакції; – критична залежність швидкості реакції від типу розчинника. – реакції є моно- та бімолекулярними. Якщо в елементарній стадії реакції (послідовності взаємодії) бере участь одна молекула або частинка, то така реакція називається мономолекулярною, а якщо дві – то бімолеку-лярною. Молекулярність визначається тільки для окремої стадії реакції; – з кінетичної точки зору реакції бувають першого та другого по-рядків. Порядок реакції визначається сумарним показником ступенів кон-центрацій реагуючих речовин в рівнянні, яка визначає загальну швидкість реакції. Якщо швидкість реакції залежить від концентрації лише одного компонента, то ми маємо реакцію першого порядку, якщо від концентрації двох реагуючих речовин – то маємо реакцію другого порядку. |