1.3.3 Класифікація органічних реакцій за типом взаємодіючих реагентів Всі реакції, що відбуваються за вільнорадикальним або іонним (нук-леофільним і електрофільним) механізмами можна схематично зобразити такими загальними схемами: 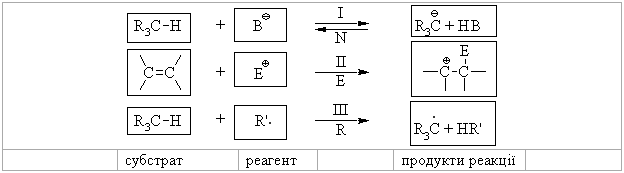 Взаємодіючі речовини поділяють на субстрати та реагенти. Такий розподіл є досить умовний, але субстратом, як правило, виступає молеку-ла, яка постачає атом Карбону для утворення нового зв’язку. В залежності від природи реагента (атакуючої частинки) всі реакції поділяються на нук-леофільні, електрофільні та радикальні. Нуклеофільні (І) – це реакції, в яких реагентом виступає нулкеофіл (В–), що має негативний заряд та хоча б одну неподілену електронну пару. Ця пара електронів утворює ковалентний зв’язок з атомом, з яким вона вступає в реакцію. Умовно всі нуклеофіли можна розділити на три групи: – аніони: 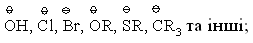 – сполуки з вільними парами електронів: 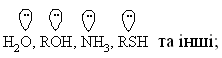 – ненасичені сполуки з -електронами: алкени, алкіни, дієни, арени. Нуклеофльні реакції позначаються символом N. Електрофільні реакції (ІІ) – це реакції, в яких реагентом виступає електрофіл (Е+), що має позитивний заряд і вакантну (вільну) орбіталь або високу спорідненість до електрона. Ця вільна орбіталь бере участь в утво-ренні ковалентного хімічного зв’язку з атомом, з яким вона вступає в реак-цію. Всі електрофільні реагенти умовно можна розділити на три групи: – катіони: 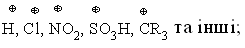 – сполуки з вільними парами електронів:  – сполуки з полярними зв’язками, в яких на атомі Карбону існують ефективні позитивні заряди: нітрили R–CN, карбонільні сполуки RCX=O та інші. Електрофільні реакції позначаються символом Е. Радикальні реакції (ІІІ) – це реакції, в яких реагентом виступає ради-кал (R), що не має заряду, але має неспарений електрон на атомній орбіта-лі. Цей неспарений електрон утворює ковалентний зв’язок з атомом, з яким він вступає в реакцію. Найбільш поширені радикали можна розташувати в послідовності зменшення їх стійкості в такий ряд:  Радикальні реакції позначаються символом R. |