1.3.4 Взаємний вплив атомів в молекулах Взаємний вплив атомів в органічних молекулах визначається розпо-ділом електронної густини в молекулі та поляризовністю ковалентних зв’язків. У більш загальному вигляді це підпорядковується фундаменталь-ній залежності органічної хімії – „структура – хімічна активність”, яка до-зволяє в якісному співвідношенні оцінити реакційну здатність органічних молекул, виходячи з їх будови, та передбачити хід і результати хімічних перетворень. В молекулах органічних речовин під впливом наявних в них різних за своєю природою атомів або атомних груп відбувається перероз-поділ електронної густини хімічних зв’язків двох ефектів: індукційнго (по -зв’язку) та мезомерного (по -зв’язку). Індукційний ефект – це зміщення електроної густини -зв’язку в напрямку більш електронегативного атома ( І-ефект).  Практично дія індуктивного ефекту „затухає” на третьому атомі Карбону. Відносно н-бутил-радикала атом Хлору, який притягує до себе електронну пару, проявляє –І-ефект. Такий же –І-ефект будуть мати насту-пні замісники (акцептори електронів): – всі атоми галогенів: F > Cl> Br > I (галогени наведено в послідовності зменшення їх –І-ефекту; – всі ненасичені замісники, –І-ефект яких зменшується по мірі зме-ншення ступеню ненасиченності: 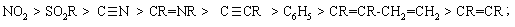 – групи атомів з повним позитивним зарядом на атомі, сполученому з атомом Карбону: 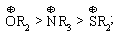 – групи атомів з семиполярним зв’язком –C–NO2, а також з подвій-ними зв’язками CR=O > CR=NR.  При цьому перерозподіл електронної густини у ланцюгу С1С2С3С4 (із її збільшенням) принципово не відрізняєтся від раніше розглянутого приклада із 1-хлорбутаном; частковий позитивний заряд на атомах Карбо-ну збільшується у такій послідовності: – > – – > – – – > – – – –. Таким чином, відносно н-бутил-радикала атом Літію, який віддає електро-нну пару, проявляє +І-ефект. Такий же +І-ефект будуть мати наступні замі-сники (донори електронів): – елементи з меншою електронегативністю, ніж атом Карбону: Li > BeR > BR2 або Na > MgR > AlR2 > SiR3; – алкільні групи в наступній послідовності зменшення їх +І-ефекту: С(СH3)3 > СH(СH3)2 > CH2CH3 > CH3. Мезомерний ефект (ефект супряження) – це зміщення електронної густини по -зв’язку в напрямку більш елекронегативного атома або групи атомів, ( М-ефект). В залежності від того, які електрони (електронні орбіталі) прийма-ють участь в спряженні, розрізняють: --супряження (перекривання двох -орбіталей); р--супряження (перекривання р- і -орбіталі) та --супря-ження (перекривання -орбіталі зв’язку С – Н і -орбіталі); табл. 1.12. У випадку -- та р--перекривання маємо ефект супряження (кон’югації), а у випадку --супряження – ефект надсупряження (гіпер-кон’югації). При передачі впливу по мезомерному ефекту (на відміну від індук-тивного) найбільш характерним є те, що перерозподіл електронної густини проходить практично по всьому ланцюгу супряження. Зміщення електронної густини у випадку мезомерного ефекта позна-чається зігнутою (дугоподібною) стрілкою. 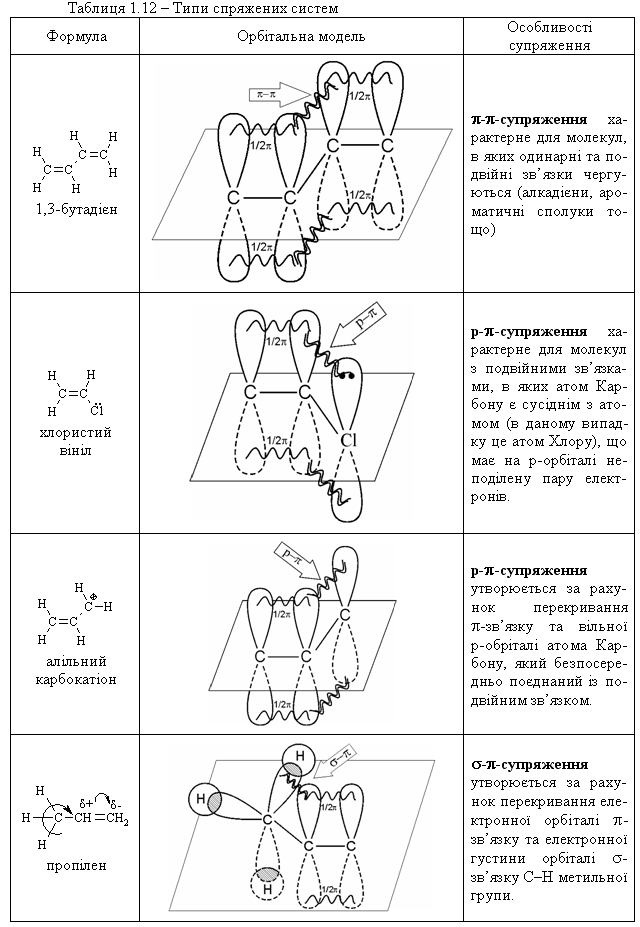 Мезомерний ефект називають позитивним (+М-ефект), якщо атоми або групи атомів віддають електронну густину -зв’язку (тобто являються донорами електронів). При цьому +М-ефект виявляють:  – атоми або атомні групи, які мають негативні заряди: –О–. Мезомерний ефект називають негативним (–М-ефект), якщо атоми або групи атомів приймають електронну густину від -зв’язку (тобто яв-ляються акцепторами електронів). При цьому –М-ефект виявляють заміс-ники, які приймають („стягують”) на себе електронну густину: 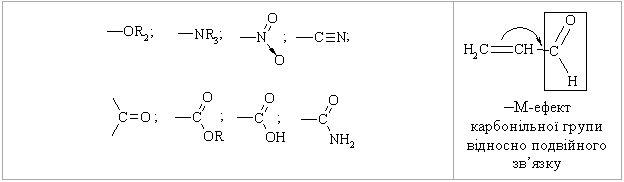 У багатьох випадках маємо сумісний вплив мезомерного та індук-ційного ефектів, які можуть співпадати або ні: 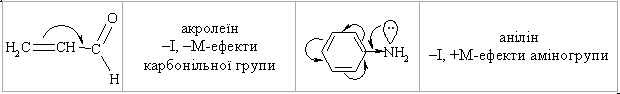 Питання для самоконтролю 1. Дати визначення поняттям: індукційний ефект ( ±І ) і мезомерний ефект ( ±М ). Показати розподіл електронної густини в молекулах: 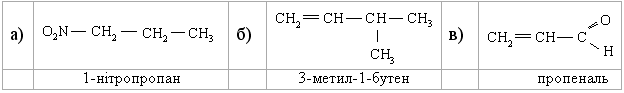 2. Дати визначення поняттям: ефект супряження, супряжена система. У формулах сполук а)-г) показати розподіл електронної густини, вказати тип супряження: 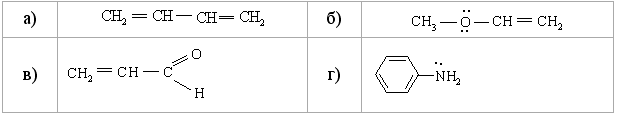 3. Дати визначення поняттям: електрофільний реагент, нуклеофіль-ний реагент. Вказати, які з реагентів а) – л) відносяться до електрофільних, а які – до нуклеофільних: 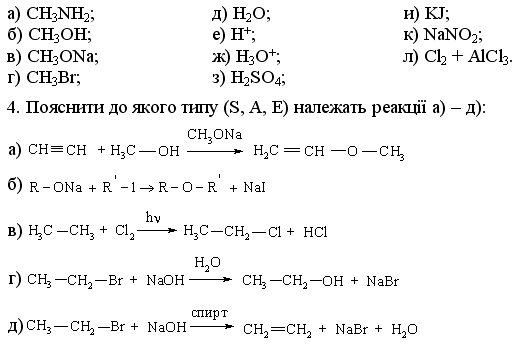 Вказати реагент і субстрат в кожній реакції. 5. Дати визначення поняттю гібридизація. Які типи гібридизації мо-жливі для атома Карбону в органічних сполуках? Вказати формулу та про-сторову напрямленість атомних орбіталей для кожного типу гібридизації. 6. Дати визначення поняттям: хімічна реакція, субстрат, реагент, 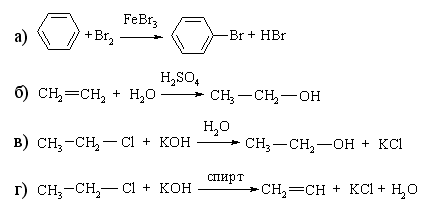 електрофіл, нуклеофіл. Вказати реагенти субстрат, каталізатор, символ ре-акції (S, A, E) у схемах а) – г): 7. Пояснити поняття індукційний ефект ( ±І ). Навести функціональні групи, які виявляють негативний індукційний ефект по відношенню до sp3-гібридного атома Карбону. 8. Навести приклади структурної, геометричної і поворотної ізомет-рії органічних сполук. Дати визначення цих видів ізомерії. 9. Які особливості ковалентного зв’язку і які фактори сприяють його гомолітичному розриву? Порівняти і пояснити стійкість первинних, вто-ринних і третинних алкільних радикалів. Які особливості зв’язку і які фак-тори сприяють гетеролітичному розриву? Навести приклади гомолізу і ге-теролізу. 10. Розташувати радикали в порядку зростання їх стабільності: 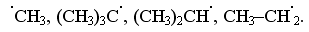 Розташувати в порядку збільшення стабільності такі іони карбонію: 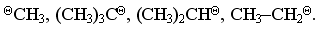 Навести необхідні пояснення.
Самостійна робота 1. Збірник тестових завдань з органічної хімії / Під ред. проф. Рансько-го А. П. – Дніпропетровськ, 2007. – С. 32-46. – ISBN 966-8018-54-0. Основна література 1. Ластухін Ю. О. Органічна хімія / Ю. О Ластухін, С. А. Воронов.– Львів: Центр Європи, 2001 – С. 71-83; С. 128-150. – ISBN 966-7022-19-6. 2. Черных В. П. Лекции по органической химии / В.П. Черных – Харьков: Золотые страницы, 2005. – С. 25-32; С. 50-54. – ISBN 966-615-155-3. 3. Грандберг И. И. Органическая химия / Грандберг И. И. – М.: Высшая школа, 1987. – С. 53-71. Додаткова література 1. Гауптман З. Органическая химия / Гауптман З., Грефе Ю., Ремане Х. – М.: Химия, 1979. – С. 169-184. |