2.2.5 Екологічні питання Похідні циклоалканів дуже поширені у природі. Вони та їх синтети-чні аналоги можуть використовуватись як інсектициди (похідні хризанте-мової кислоти): 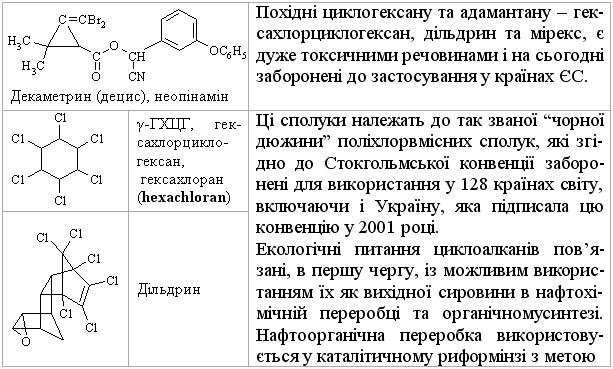 отримання мінеральних палив для ДВЗ з високим октановим числом. Ор-ганічний синтез пов’язаний, перш за все, з синтезом адипінової та ε-амінокапронової кислот та зменшенням побічних продуктів цих реакцій, а також з використанням їх у синтезі полімерних поліамідів – найлону і кап-рону. Велике значення має промислове виробництво капролактаму. Капролактам використовують для отримання пластмас, плівок та синтетичного волокна. Його отримують із різної вихідної сировини, що супроводжується утворенням різних побічних продуктів. Розглянемо осно-вні методи: а) із циклогексану виробляють 60 % капролактаму: 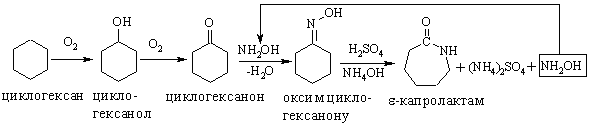 при цьому утворюється велика кількість (NH4)2SO4: 4,5 т на 1 т капролак-таму. Витратні показники технологічного процесу на 1 т ε-капролактаму такі: циклогексанону – 1 т; олеуму – 1 т; аміаку – 0,9 т; сульфатної кислоти – 0,52 т; водню – 420 м3; кисню – 340 м3. При цьому утилізація (NH4)2SO4 до NH3 та SO3 дозволяє зменшити витрати NH3 до 0,24 т, а також здійснити рецикл олеому та H2SO4; в свою чергу NH3 використовують для утворення гідроксиламіну: б) із циклогексанону DSM-процесом отримують капролактам високої чистоти з низьким виходом сульфату амонію: 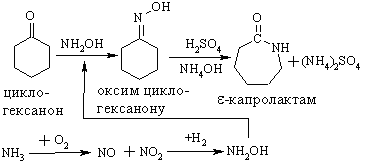 Витратні показники технологічного процесу на 1 т капролактаму: циклогексану 0,9 т; аміаку 0,8 т; сульфатної кислоти 1,4 т; водню 96 кг; пару 6600 кг; електроенергії 224 кВт/г; технічної води 2,5 т. У цьому випадку утворюється лише 1,1 т (NH4)2SO4. в) із толуолу. Процес складається із трьох стадій: 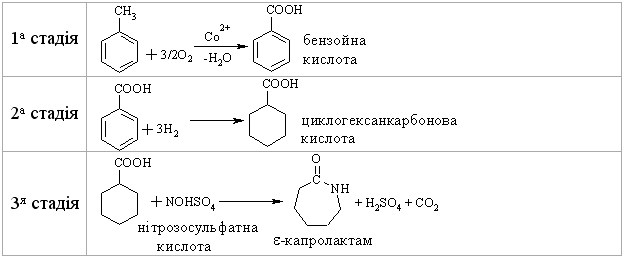 При порівнянні техніко-економічних показників наведених методів виробництва капролактаму необхідно відзначити. що процес із викорис-танням толуолу є найбільш економічно вигідним. Питання для самоконтролю 1. Добути алкени з відповідних галогеналканів: а) 2,3-дихлорбутан; б)1- бром-3-метилбутан, в) 2,3-дихлор-З-метилпентан. Для синтезованих алке-нів навести схеми реакцій гідратації і гідрогалогенування та пояснити механізм реакції гідрогалагенування для б). Вказати умови реакцій. 2 Здійснити перетворення в кілька стадій: а) 2-метилпентан → 2-метил-2-пентен, б) пропілен → 2,3-диметил-2-бутен, в) 4-метил-2-пентен → 2-метил-2-пентен. Навести схеми відповідних реакцій, вказати їх умови, для продуктів навести реакції озонолізу. Яке значення має реакція озону-вання алкенів? 3. Визначити структурну формулу вуглеводню загальної формули С6Н12, який знебарвлює бромну воду і розведений розчин KMnO4, a при озонолізі утворює суміш формальдегіду і метилбутанону (СН3)2СН–СО–СН3. Навести схеми відповідних реакцій. Пояснити механізм реакції бромування. 4. Здійснити перетворення: 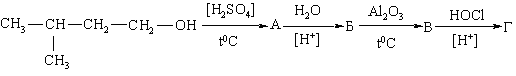 Дати назви процесам та сполукам. Для продукту А навести схему: механізм аніонної полімеризації. 5. Визначити структурну формулу вуглеводню C7H14, який знебарвлює бромну воду, розчиняється в концентрованій сульфатній кислоті, при оки-сненні концентрованим розчином перманганату калію утворює суміш оцтової і ізовалеріанової (СН3)2СНСН2СООН кислот. Навести схеми відпо-відних реакцій. Синтезувати алкен C7H14 двома способами: а) із спирту; б) із моногалогенопохідного. 6. При нагріванні н-бутилйодиду із спиртовим розчином гідроксиду натрію добуто відповідний алкен. Пояснити механізми його реакцій з: а) хлороводнем, б) гіпохлоритною кислотою. 7. Навсти реакції добування 2-бутену та ізобутену із відповідного: а) монохлоралкану, б) дихлоралкану, в) спирту. Вказати умови реакції. Навес-ти для ізобутену схему та механізм катіонної полімеризації в присутності H2SO4. 8. За допомогою реакцій гідратації і дегідратації здійснити такі пе-ретворення: а) 1-бутен → 2-бутен, б) 4-метил-1-пентен → 4-метил-2-пентен, в) 2-метил-1-пентен → 2-метил-2-пентен. Для 2-метил-1-пентену пояснити механізми електрофільного та радикального (у присутності перо-ксиду водню) приєднання бромоводню. 9. Визначити структурну формулу вуглеводню загальної формули С4Н8, який знебарвлює бромну воду, при гідратації утворює третинний спирт, при окисненні – суміш ацетону і мурашиної кислоти, а при озонолі-зі – мурашиний альдегід та ацетон. Навести схеми відповідних реакцій, пояснити механізм реакції бромування. Синтезувати вуглеводень С4Н8: а) із спирту; б) моногалогеналкану. 10. Алкен нормальної будови містить подвійний зв'язок біля першого атома Карбону, при бромуванні 0,7 г приєднує 1,6 г брому. Встановити формулу алкену, навести схеми і механізм реакцій гідратації та гідро-бромування.
Самостійна робота 1. Збірник тестових завдань з органічної хімії / Під ред. проф. Рансько-го А. П. – Дніпропетровськ, 2007. – С. 64-67. – ISBN 966-8018-54-0. Основна література 1. Ластухін Ю. О. Органічна хімія / Ю. О Ластухін, С. А. Воронов. – Львів: Центр Європи, 2001. – С. 567-588. – ISBN 966-7022-19-6. 2. Шабаров Ю. С. Органическая химия / Шабаров Ю. С. – М.: Химия, 1996. – Ч. 1. – С. 502-552. – ISBN 5-7245-1059-6. 3. Моррисон Р. Органическая химия / Моррисон Р., Бойд Р. – М.: Мир, 1974. – С. 264-295. Додаткова література 1. Грандберг И. И. Органическая химия / Грандберг И. И. – М.: Высшая школа, 1987. – С. 189-209. 2. Cтойкие органические загрязнители экосистемы / Ранский А. П., Кова-ленко В.С., Ткачук М. Ф. [та ін.] // Вопросы химии и хим. технологии. – ISSN 0321-4095. 2006, № 5. – С. 239-245. 3. Охрана окружающей среды в нефтехимической и химической промыш-ленности / Под ред. проф. Мокрого Е. Н. – Львов: ЛГУ, 1989. – 159 с |