2.5.3 Будова алкадієнів В алкадієнах атоми Карбону подвійного зв’язку знаходяться у sp2-гі-бридному стані. Орбітальна модель молекули бутадієну-1,3 наведена на рис. 2.12. 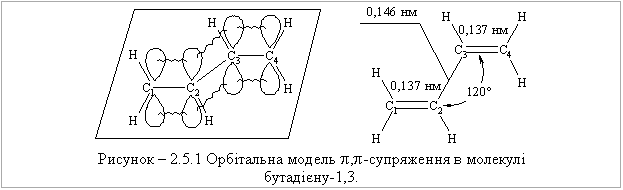 Молекула дивінілу копланарна, тобто всі гібридизовані sp2-АО знахо-дяться у одній площині, а негібридизовані pz-орбіталі атомів Карбону роз-ташовуються у перпендикулярній до неї площині. -Зв’язок в бутадієні-1,3 утворюється при перекриванні s-атомних орбіталей Гідрогену і гібридизо-ваних sp2-орбіталей атома Карбону або при перекриванні атомів Карбону між собою; природа утворення -зв’язку дещо інша, ніж у алкенах. У цьо-му випадку маємо ,-супряження, при якому при перекриванні pz-орбіта-лей атомів Карбону С1-С2 та С3-С4, має місце часткове додаткове перекри-вання pz-орбіталей атомів Карбону С2-С3. При цьому відбувається перероз-поділ (делокалізація) -електронної густини з утворенням єдиної -електронної супряженої системи.  бутадієну-1,3: Нексп. = -238,6 кДж/моль, Нрозрах. = -251,2 кДж/моль. Різниця Нексп. – Нрозрах. = -238,6 - (-251,2 )= 12,6 кДж/моль в енергі-ях називається енергією супряження. За рахунок часткового перекривання pz-орбіталей атомів Карбону С2-С3 в молекулі бутадієну-1,3 вільне обертання навколо цього зв’язку ускладнюються, що приводить до утворення S-цис- та S-транс-ізомерів: 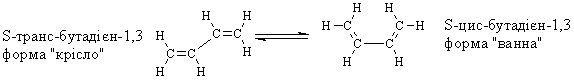 |