3.2.3 Хімічні властивості аренів Хімічні властивості бензену та його похідних визначаються наявніс-тю 6-електронної супряженої системи. Арени – хімічні сполуки з яскраво вираженим нуклеофільним характером, тому для них характерні реакції електрофільного заміщення (SE) із збереженням ароматичного циклу. Реа-кції приєднання (АЕ) для аренів менш характерні, тому як при цьому по-рушується ароматичність циклу; лише в жорстких умовах арени вступають у реакцію окиснення. Реакції електрофільного заміщення (SE) – головний і найважливіший тип реакцій аренів: 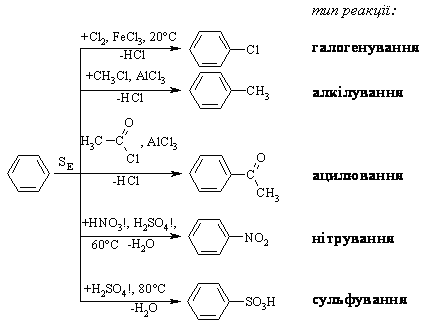 Ці реакції відбуваються за механізмом електрофільного заміщення (SE): 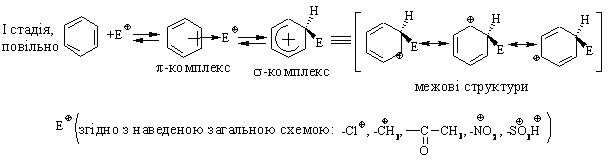 На першій стадії спочатку утворюється нестійкий -комплекс, який потім переходить у -комплекс (карбокатіон). Утворення останнього від-бувається із порушенням ароматичної системи і переходом одного атома карбону в sp3-гібридний стан. Утворення -комплексу є найбільш енерге-тичною стадією реакції, тому позитивний заряд карбокатіона делокалізу-ється за допомогою наведених резонансних межових структур. 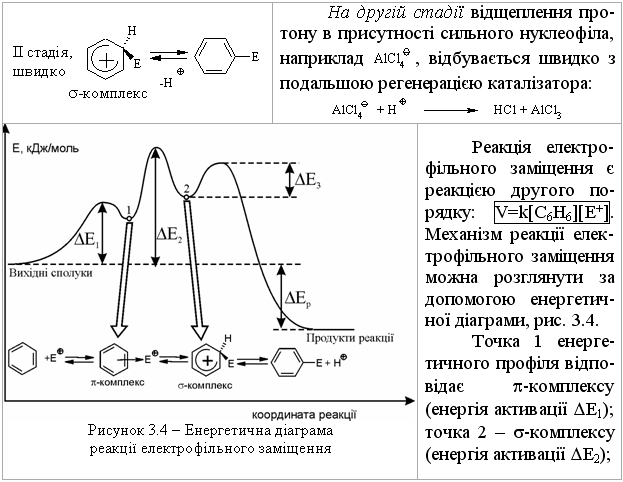 відщепленню протона і утворенню продукта реакції відповідає енергія ак-тивації Е3. По даній енергетичній діаграмі реакція екзотермічна, що від-повідає Ер реакції. Правила орієнтації при заміщенні у бензеновому ядрі. Молекула бензену симетрична і тому всі атоми карбону абсолютно рівноцінні при утворенні монозаміщених продуктів реакції. Якщо у бензе-новому ядрі уже є замісник і ми вводимо туди ще один, то при цьому мо-жуть утворюватись наступні ізомери: 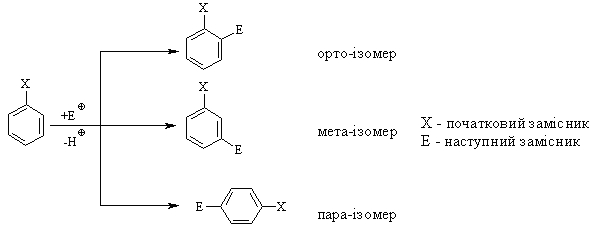 Положення, яке буде займати наступний замісник визначається при-родою початкового замісника (М та І-ефектами). Згідно до цього почат-кові замісники (Х) можна розділити на дві групи: замісники І та замісники ІІ роду. Замісники І роду (орто- та пара-орієнтанти в реакціях SE) – це атоми або групи атомів, які є донорами електронів. За винятком алкіль-них радикалів (Alk-) вони мають вільні електронні пари на атомі, що без-посередньо поєднується із ароматичним ядром: 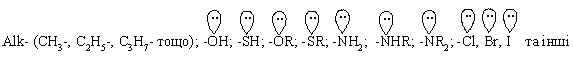 Збагачення ароматичного ядра електронною густиною прискорює реакції електрофільного заміщення (SЕ): 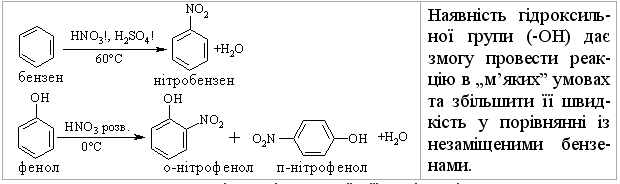 Таким чином, механізм орієнтуючої дії замісників І роду полягає у тому, що вони збільшують ступінь делокалізації позитивного заряду -комплекса у порівнянні із незаміщеним -комплексом бензену. Це означає, що стабільність такого -комплекса збільшується, а енергія активації зме-ншується, що приводить до прискорення реакції. Порівняння відносної стабільності о-, м- та п--комплексів розглянемо на прикладі реакції SE для фенолу: 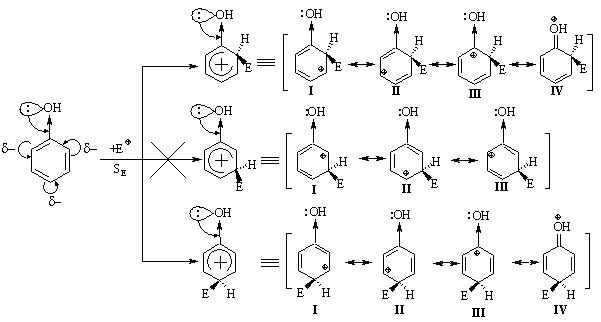 Наведена схема показує, що у випадку о- та п--комплексів делока-лізація заряду можлива завдяки чотирьом межовим структурам (I-IV), тоді як у випадку м--комплексу така делокалізація можлива лише за рахунок трьох межових структур (І-ІІІ), тому реакція SE йде переважно в орто- та пара-положення. Замісники ІІ роду (мета-орієнтанти в реакції SE) – це групи атомів, які є акцепторами електронів. Вони мають цілий або частково позитив-ний заряд на атомі, що безпосередньо поєднується із ароматичним ядром: 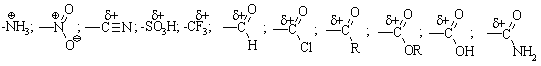 Замісники ІІ роду зменшують електронну густину в бензеновому яд-рі і знижують швидкість реакції SE у порівнянні із незаміщеним бензеном: 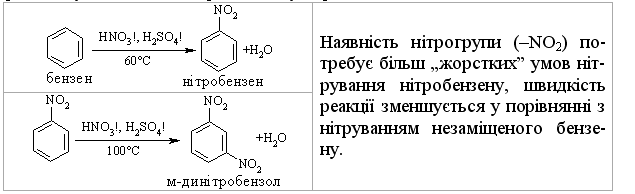 Механізм орієнтуючої дії замісників ІІ роду (реакція SE) полягає в тому, що вони зменшують ступінь делокалізації позитивного заряду -комплексу у порівнянні із незаміщеним -комплексом бензену. При цьому стабільність такого -комплексу зменшується, а енергія активації збільшу-ється, що приводить до зменшення швидкості реакції. Порівняння віднос-ної стабільності о-, м- та п--комплексів розглянемо на прикладі реакції нітрування нітробензену: 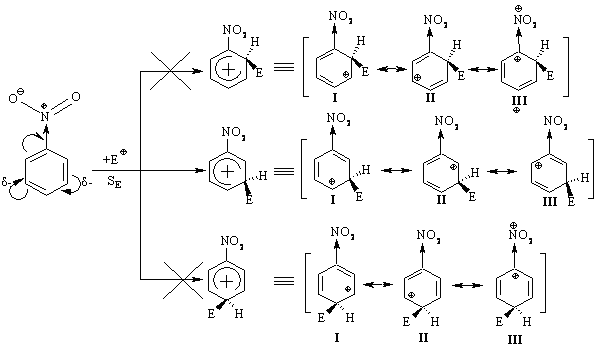 Наведена схема показує, що у випадку м--комплексу делокалізація заряду відбувається згідно з трьома межовими структурами (І-ІІІ), тоді як у випадку о- та п--комплексів структури (ІІІ) вкрай невигідні, оскільки по-зитивні заряди знаходяться на двох суміжних атомах і імовірність їх існу-вання дуже мала. Тому делокалізація позитивного заряду у випадку о- та п--комплексів фактично зводиться до двох межових структур – І та ІІ, тому реакція йде переважно в мета-положення. Узагальнюючи правила орієнтації при заміщені у бензеновому ядрі треба відмітити, що: правила орієнтації не мають обов’язкового характера, а лише вказу-ють на два головних напрямки реакції; правила орієнтації діють і в небензоїдних ароматичних сполуках. Реакції приєднання. Реакції приєднання (гідрування, хлорування) для аренів малохарак-терні і вимагають більш жорстких умов, ніж у випадку алкенів та алкінів. 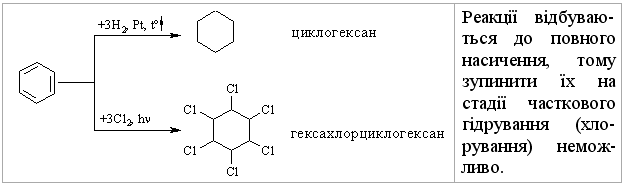 Реакції окиснення. Арени за звичайних умов стійкі до дії сильних окисників (KMnO4, K2Cr2O7, CrO3). Реакція відбувається в “жорстких” умовах із використан-ням V2O5 як каталізатора: 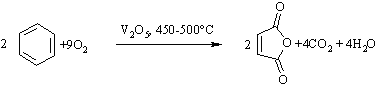 Гомологи бензену, що мають бокові вуглеводневі ланцюги, окисню-ються значно легше: 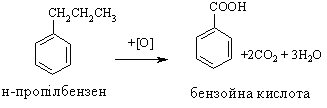 Особливості окиснення гомологів бензену: незалежно від довжини бічного ланцюга він (ланцюг) окиснюється до кінцевої карбоксильної групи; при наявності кількох бокових ланцюгів, кожний наступний окисню-ється у більш “жорстких” умовах, ніж попередній. Реакції озонування. Арени взаємодіють із озоном за схемою: 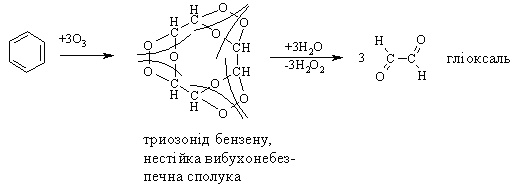 |