3.2.4 Екологічні питання Екологічні питання хімії аренів пов’язані з їх використанням в син-тезі промислових органічних сполук, реакціями галогенування, алкілуван-ня, ацилування (acylation), сульфування, нітрування, нітрозування та азо-сполучення. Отримані органічні сполуки, в свою чергу, є вихідними речо-винами для синтезу величезної кількості промислових, сільськогосподар-ських, фармацевтичних, косметичних та інших виробів та препаратів. Ви-робництво цих органічних сполук повинно бути пов’язане з впроваджен-ням безвідходних або екологічно чистих сучасних технологій. Окрім цьо-го, найближчі гомологи бензену використовуються як розчинники. Наве-демо фізико-хімічні та токсикологічні характеристики деяких сполук цього класу.  При хронічному отруєнні на виробництві вражає нирки, печінку, кістковий мозок і приводить до зменшення вмісту в крові червоних кров’яних тілець (білокрів’я). В промисловості використовується як сировина для синтезу циклогексану, фенолу, стиролу, аніліну, алкілбензенсульфонатів, інсекти-цидів, барвників, лікарських препаратів.  бензойної кислоти, 20 % якої з глюкуроновою кислотою виводиться з се-чею у вигляді глюкоуроніда. Толуен використовують для синтезу тротилу (2,4,6-тринітротолуолу), бензойної кислоти, сахарину, домішок до моторних па-лив для підвищення октанового числа.  Ксилоли використовують для добування фталевих кислот, толуену, а також як розчинник у лаках, фарбах та мастилах, а також як високооктано-ву домішку до авіаційних бензинів. Технологічна схема синтезу етилбензену 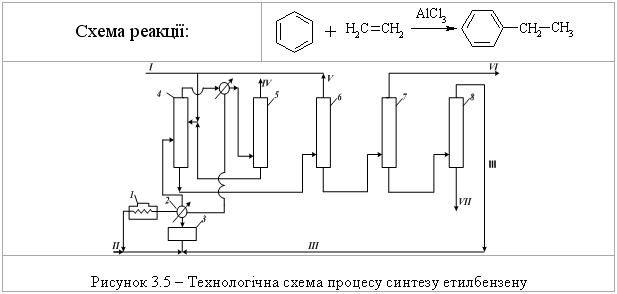 Устаткування: 1 – конденсатор; 2 – теплообмінник; 3 – реактор алкілування; 4-8 – ректифікаційні колони. Матеріальні потоки: І – свіжий бензен, ІІ – етилен, ІІІ – рецикл, IV – легкокип-лячі домішки, V – домішки бензену, VI – етилбензен, VII – кубовий залишок. Свіжий бензен І, змішують з бензеном рециклу V, нагрівають у теп-лообміннику 2 та випаровують у конденсаторі 1. Далі суміш пари бензену, етилену ІІ та рециклу ароматичних вуглеводнів надходить до реакто-ру алкілування 3. Каталізатор розроблений фірмою „Мобіл ойл”. Далі у колоні 4 виділяється бензен та розчинені в ньому гази, які утворюються у колонні 5 і використовуються як паливо, а бензен рециркулює назад до ре-актору алкілування. Кубова рідина із колони 4 спрямовується до системи, що складається із трьох ректифікаційних колон 6-8, де виділяють відповід-но, бензен, етилбензен та поліалкілбензени. Кубовий залишок VII викорис-товують як паливо, за рахунок чого забезпечують 60 % необхідних тепло-витрат процесу. Технологічна схема виробництва стиролу 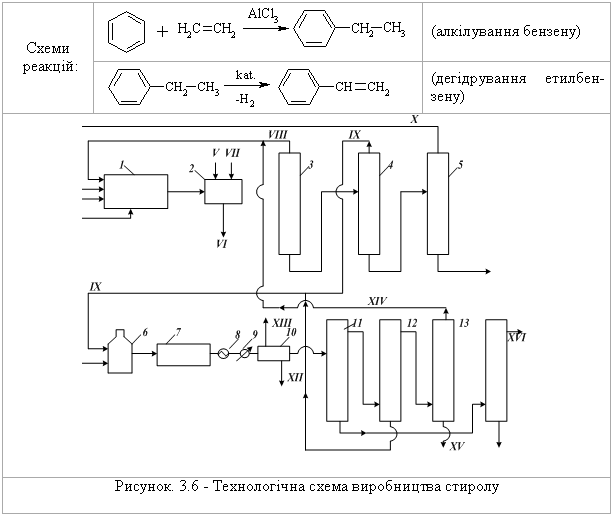 Устаткування: 1 – реактор алкілування; 2 – нейтралізатор каталізатора; 3-5 – ректифікаційні колони; 6 – змішувачі; 7 – реактор дегідрування; 8 – теплообмінник; 9 – конденсатор; 10 – сепаратор; 11-12 – ректифікаційні колони. Матеріальні потоки: І – свіжий бензен, ІІ –етилен, III – поліетилбензен, IV – хлористий алюміній, V – вода, VI – розчин хлористого алюмінію, VII – розчин соди, VIII – непрореагувавший бензен, IX – етилбензен, X – поліетиленбензени, XI – пара, XII – водний шар, XIII – несконденсовані гази, XIV – бензен, XV – толуен, XVI – сти-рол, XVII – смолоподібні домішки. Осушений бензен І у надлишку змішується із етиленом ІІ та рецик-лом поліетилбензену ІІІ та надається до реактора алкілування 1. Алкілу-вання відбувається у рідкий фазі у присутності каталізатора AlCl3 – IV. Ка-талізатор безперервно виводиться із процесу, регенерується та повертаєть-ся до процесу. Реакційну суміш потім обробляють водою V для видалення розчину хлористого алюмінію VI, промивають розчином Na2CO3 у апараті 2. Із продуктів алкілування у ректифікаційних колонах 3-5 виділяють за-лишок бензену VIII, етилбензен IX та поліетилбензени Х. Бензен та полі-етилбензени повертають до реактора алкілування, а виділений етилбензен змішують з перегрітою водяною парою ХІ у змішувачі 6 та подають на де-гідрування до реактора 7. Продукти дегідрування охолоджують у теплооб-міннику 8 та конденсують у апараті 9. В сепараторі 10 відокремлюють ор-ганічну фазу від водного конденсату ХІІ. З водного конденсату відганяють розчинені вуглеводні, а воду використовують в кип’ятильниках ректифіка-ційних колон. Незконденсований газ застосовують як паливо ХІІІ. Органі-чну фазу розділяють у колоні 11. Верхній продукт з цієї колони підлягають додатковому розділенню у колонах 12 та 13. У колоні 12 відганяють суміш бензену-толуену, а залишок етилбензену в кубі повертають до реактору де-гідрування. Суміш бензен-толуен розділяють у колоні 13. Бензен XIV по-вертають на стадію алкілування, а толуен XV виділяють як побічний про-дукт. В колоні 14 очищують стирол-сирець. Витратні показники на 1 т стиролу: етилен – 307,0 кг; бензен – 820,0 кг; каталізатори – 420,0 кг; пара – 1700,0 кг; паливо – 1530,0 ккал; охоло-джуюча вода – 65000,0 кг; електроенергія – 66,0 кВт•год. Як побічні продукти отримують 52 кг толуену, 9 кг 27 %-ного водно-го розчину AlCl3 та 1510 водного конденсату. Технологічна схема уловлювання бензену при виробництві мале-їнового ангідриду 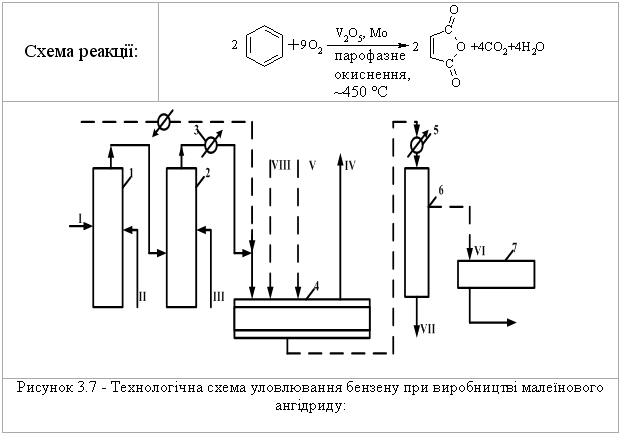 Устаткування: 1,2 – скрубери; 3 – теплообмінник; 4 – адсорбер; 5 – конденса-тор; 6 – сепаратор; 7 – ємність. Матеріальні потоки: І – газ, ІІ – розчин карбоната натрія, III – вода, IV – очи-щені гази, V – водяна пара, VI – бензен, VII – вода, VIII – повітря. Газ на виході із реактора промивають водою для уловлювання малеї-нового ангідриду. Потім газ І послідовно вводять до скруберів 1 та 2. У скрубері 1 газ промивають протитоком розчину карбонату натрію ІІ з ме-тою уловлювання мурашиної, оцтової та акрилової кислот, а також парів малеїнового ангідриду. Потім газ промивають водою ІІІ у скрубері 2 для вилучення домішок карбонату натрію. Промиті гази підігріваються у теп-лообміннику 3 до 40 С для того, щоб вологість була нижче 7 %, і спрямо-вуються до абсорбції, що складається із трьох-чотирьох абсорберів 4. Пари бензену уловлюються активованим вугіллям, а очищені гази IV викида-ються до атмосфери. Адсорбери працюють 3 год., після чого із них виді-ляють бензен і регенерують активоване вугілля. Регенерацію здійснюють у три етапи. Спочатку адсорбент обробляють водяною парою V. Пари бензе-ну та води конденсуються у конденсаторі 5. У сепараторі 6 відокремлюють бензен VI та воду VII. Бензен повертають на окислення, а воду – на стадію вилучення пари малеїнового ангідриду. Далі вологий адсорбент продува-ють гарячим повітрям VIII, охолоджують до 40С, та потім адсорбери під-ключають до процесу. При капітальних витратах на устаткування виділен-ня бензену (330 тис. т/рік), вона окупиться протягом півтора роки. Питання для самоконтролю 1. Навести схеми реакцій н-пропілбензолу з такими реагентами: а) Н2 (Nі, 200°С, 100 атм); б) розчин перманганату калію; в) нітруюча суміш; г) роз-бавлена нітратна кислота; д) Br2 (Fe); є) Br2 (һν). Відплвідь обґрунтувати. Порівняти механізм реакції (д) і (є). 2. Запропонувати способи добування етилбензолу із таких сполук: а) бен-золу і етилхлориду; б) ацетофенону (С6Н5-СОСН3); в) стиролу; г) α-фенілетилового спирту (С6Н5СН(ОН)СН3); д) β-фенілетилхлориду (С6Н5СН2СН2Cl). Навести схеми відповідних реакцій, вказати умови їх пе-ребігу. Навести механізм реакції (а) та її енергетичну діаграму. 3. Вказати, які арени утворюються при дії на бензол пропілхлориду в при-сутності AlCl3. Навести схему та механізм реакції, дати назви сполукам. 4. Запропонувати схеми синтезу етилбензолу із сполук (а-д), використову-ючи будь-які аліфатичні сполуки та неорганічні реагенти: а) бензол; б) стирол; в) фенілацетилен; г) α-фенілетиловий спирт; д) 1-хлор-1-фенілетан. Для реакції (а) навести механізм та енергетичну діаграму. Дати назви всім процесам та сполукам. 5. Встановити будову арену загальної формули С9Н12, якщо при окисненні він утворює бензолтрикарбонову кислоту, а при бромуванні в присутності AlBr3 лише одне монобромпохідне. Навести механізм формування С9Н12, дати назви всім сполукам. Запропонувати спосіб добування С9Н12. 6. Встановити будову похідного бензолу, який знебарвлює бромну воду, при окисненні хромовою сумішшю утворює бензойну кислоту, а при окис-ненні за Вагнером – 3-феніл-1,2-пропандіол. Запропонувати спосіб добу-вання цієї сполуки. 7. Навести схему та механізм ацетилювання бензолу за реакцією Фріделя-Крафтса. За допомогою енергетичної діаграми цього процесу порівняти стійкість π- та σ-комплексів, які утворюються на проміжних стадіях аци-лювання. 8. Пояснити, чому алкілування бензолу ізо-бутилбромідом за реакцією Фріделя-Крафтса призводить до утворення трет-бутилбензолу. Запропону-вати механізм такого перетворення. Яким способом можна добути ізо-бутилбензол? Навести схему відповідної реакції, вказати умови її перебігу. 9. Пояснити будову продуктів алкілування бензолу: а) 2-бутен-1-олом в присутності ортофосфатної кислоти; б) 2-метилбутеном-2 в присутності сульфатної кислоти; в) неопентилхлоридом в присутності хлориду алюмі-нію. Навести схеми та механізми відповідних реакцій. 10. Встановити будову вуглеводнів А і Б загальної формули С6Н6, якщо ву-глеводень А миттєво знебарвлює бромну воду і розчин KMnO4, а Б – інер-тний по відношенню до цих реагентів. Обидва вуглеводні не реагують з аміакатом срібла, зате для Б характерні реакції SЕ. Навести схеми відповід-них процесів та загальний механізм реакції SЕ для вуглеводню Б.
Самостійна робота 1. Збірник тестових завдань з органічної хімії / Під ред. проф. Рансько-го А. П. – Дніпропетровськ, 2007. – С. 72-81. – ISBN 966-8018-54-0. Основна література 1. Гауптман З. Органическая химия / Гауптман З., Грефе Ю., Ремане Х. – М.: Химия, 1979. –С. 252-268. 2. Ластухін Ю. О. Органічна хімія / Ю. О Ластухін, С. А. Воронов. – Львів: Центр Європи, 2001. – С. 595-662. – ISBN 966-7022-19-6. 3. Черных В. П. Лекции по органической химии /В. П. Черных. – Харьков: Золотые страницы, 2005. – С. 107-122. – ISBN 966-615-155-3. Додаткова література 1. Грандберг И. И. Органическая химия / Грандберг И. И. – М.: Высшая школа, 1987. – С. 168-187. 2. Моррисон Р. Органическая химия / Моррисон Р., Бойд Р. – М.: Мир, 1974. – С. 330-390. 3. Охрана окружающей среды в нефтехимической и химической промыш-ленности / Под ред. проф. Мокрого Е. Н. – Львов: ЛГУ, 1989. – С. 111-120. |