4.1.5 Екологічні питання Екологічні питання хімії галогеновмісних органічних сполук пов’язані, насамперед, з виробництвом та їх використанням в синтезі по-лімерних матеріалів (полівінілхлорид – ПВХ; політетрафторетилен – ПТФЕ (Ф-4); виробництві поліхлордифенілів (ПХД), як технічних рідин для електротехнічного обладнання (трансформатори та конденсатори), ін-сектицидів у сільському господарстві та холодоагентів (хладонів, фреонів) в холодильній техніці. Виходячи з цього, наведемо деякі найважливіші сполуки цього класу.  який є мономером синтезу політетрафторетилену (Ф-4). ТФЕ не токсич-ний, але при його окисненні та піролізі можуть утворюватись надзвичайно токсичні продукти. Найбільшу загрозу складає перфторізобутилен – на-багато токсичнійший, ніж фосген.  При освітлені хлороформ окиснюється до токсичного фосгену: 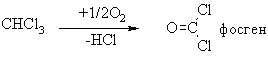 Тому його зберігають у темних склянках з добавкою (~ 1 %) етано-лу, який стабілізує процес і частково реагує з фосгеном. При взаємодії хлороформу з нітратною кислотою утворюється хлорпікрин: 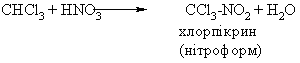 який застосовувався раніше як бойова токсична речовина, а зараз служить інсектицидном для фумігації складських зернових приміщень.  Фізіологічна дія сполук класу ПХД: викликає хворобу Дауна, вражає психіку дітей; сполуки схильні до біомутації і посилюють токсичну дію інших сполук за рахунок ефекту синергізма. Питання знезараження непридатних пестицидних препаратів, що на-копичені в Україні, стосуються багатьох класів хімічних сполук. Але хло-рорганічні пестицидні препарати займають серед них особливе місце, що обумовлено їх фізико-хімічними та біохімічними властивостями: високою стійкістю до зовнішніх факторів впливу навколишнього середовища, що пояснює наявність їх у грунтах та грунтових водах протя-гом тривалого часу, а також здатністю переміщуватись на великі відстані із однієї країни в іншу; високою токсичністю, як індивідуальних діючих речовин пестици-дних препаратів, так і можливими ще більш токсичними продуктами їх те-рмічного знезараження (діоксини); здатністю накопичуватись у жирових тканинах тварин та людини, викликаючи при цьому чисельні тяжкі захворювання (табл. 4.8). Це спонукало Світове співтовариство (128 країн, включаючи і Укра-їну) 23.05.2001 р. підписати в Стокгольмі (Швеція) Конвенцію про стійкі органічні забруднювачі (СОЗ), („чорну дюжину”), включивши туди 12 особливо токсичних речовин (табл. 4.7). Конвенція мала за мету „охорону здоров’я людини та навколишнього середовища від стійких органічних за-бруднювачів” і була спрямована на скорочення використання, заборону та подальшу ліквідацію цих речовин. ВР України в квітні 2007 р. ратифікува-ла закон "Про ратифікацію Стокгольмської конвенції про стійкі органічні забруднювачі”. В табл. 4.9 наведені фізико-хімічні та токсикологічні характеристи-ки інших хлорорганічних пестицидних препаратів, що підлягають знеза-раженню. При цьому необхідно відмітити, що найбільш прийнятим для змішаних та неопізнаних пестицидних препаратів є метод термічного знезараження таких складних та токсичних об’єктів з обов’язковим жо-рстким контролем газоподібних та твердих відходів технологічних про-цесів, що при цьому використовуються. Нижче наведені деякі технологічні схеми високотемпературного спалювання хлорорганічних відходів різних виробництв (Рис. 4.3-4.8), що зосереджені, в основному, на Західній Україні (ТОВ „Оріана-Галев”, м. Калуш). Технологічна схема високотемпературного спалювання хлорорганічних відходів 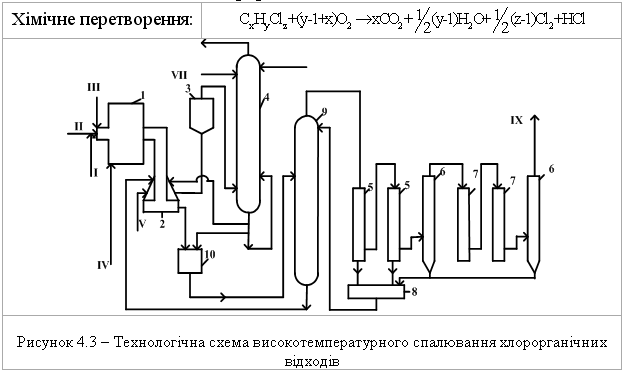 Устаткування: 1 – циклонна піч; 2 – занурювальне охолодження; 3 – сепаратор; 4 – абсорбер; 5 – водяний холодильник; 6 – тумановідокремлювач; 7 – розсільний хо-лодильник; 8 – збірник концентрованої НС1; 9 – колона дистиляції; 10 – збірник соля-ної кислоти. Матеріальні потоки: І – хлорорганічні відходи, ІІ – вода, III – повітря, IV – пар, V – СаС12 – розсіл, VI – абгази; VII – вода, VIII – розчин лугу, IX – 100 % НС1.Широке застосування знайшов процес спалювання хлорорганічних відходів у циклонних печах. Потужність устаткування 4 т/год. відходів або 28 тис. т/рік. гідрогенхлориду. Доцільним є включання печей для спалювання хлорорганічних від-ходів до стадії технологічних процесів. Таке рішення дає ряд переваг: 1. Продукти спалювання, що містять гідрогенхлорид та хлор, надходять до реактору окиснення, де гідрогенхлорид та хлор вилучаються розплавом хлориду міді(І) за реакцією: 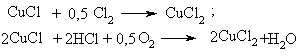 Хлорид міді (ІІ), що прицьому утворюється потім надходить до реакто-ру оксихлоринолізу. 2. Хлороганічні відходи використовують та переробляють у самому про-цесі, без виводу їх за межі устаткування. 3. Виключена необхідність подавляти утворення вільного хлору, так як він використовується у самому процесі. 4. Ступінь використання хлору досягає 99,0 %. 5. Відсутня стадія виділення гідрогенхлорид із водного розчину. 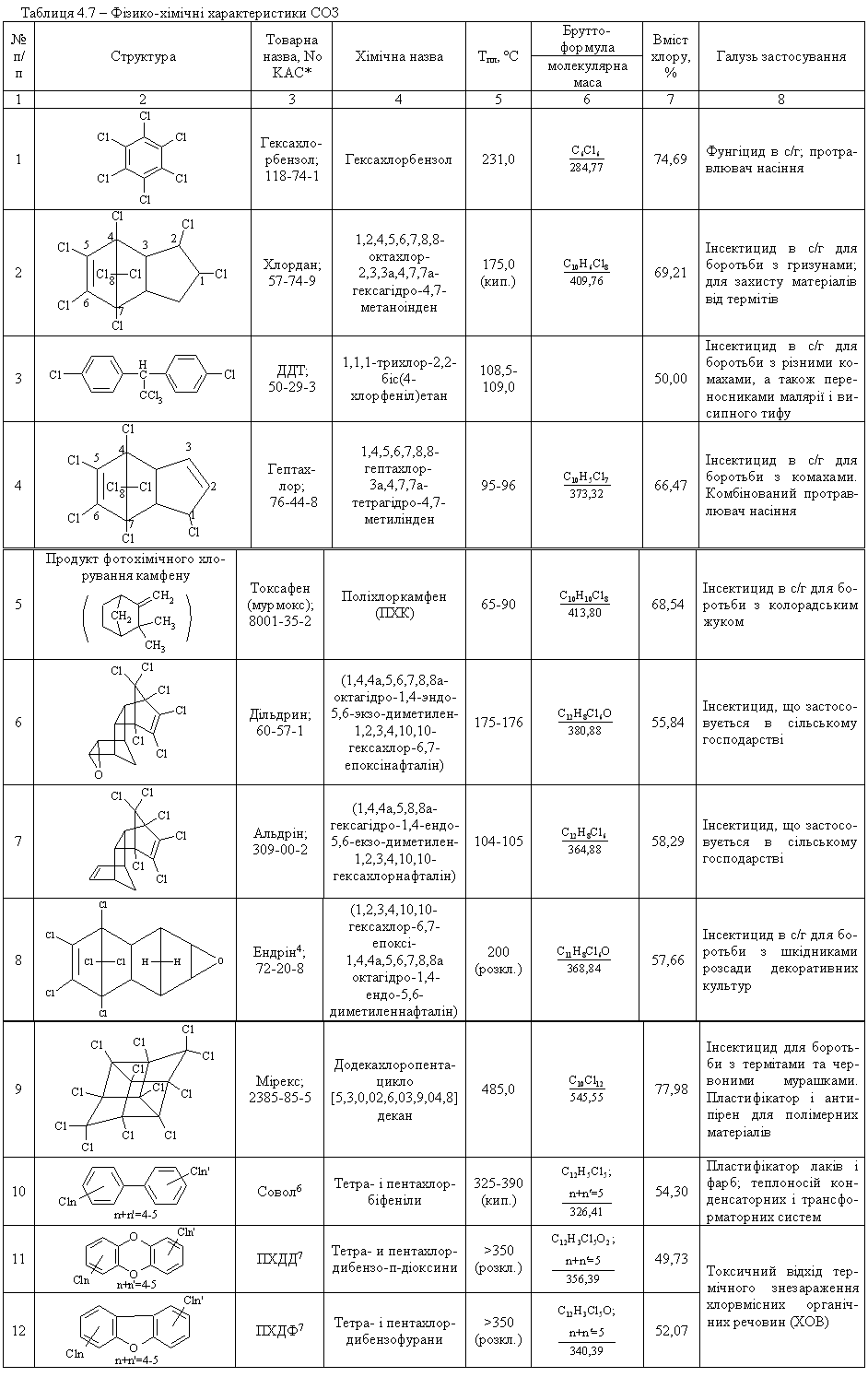 Примітка: * номер хімічної сполуки в реєстрі Служби підготовки аналітичних зразків з хімії (КАС). Додатки А, В, С матеріалів Стокгольмської конвенції по СОЗ. 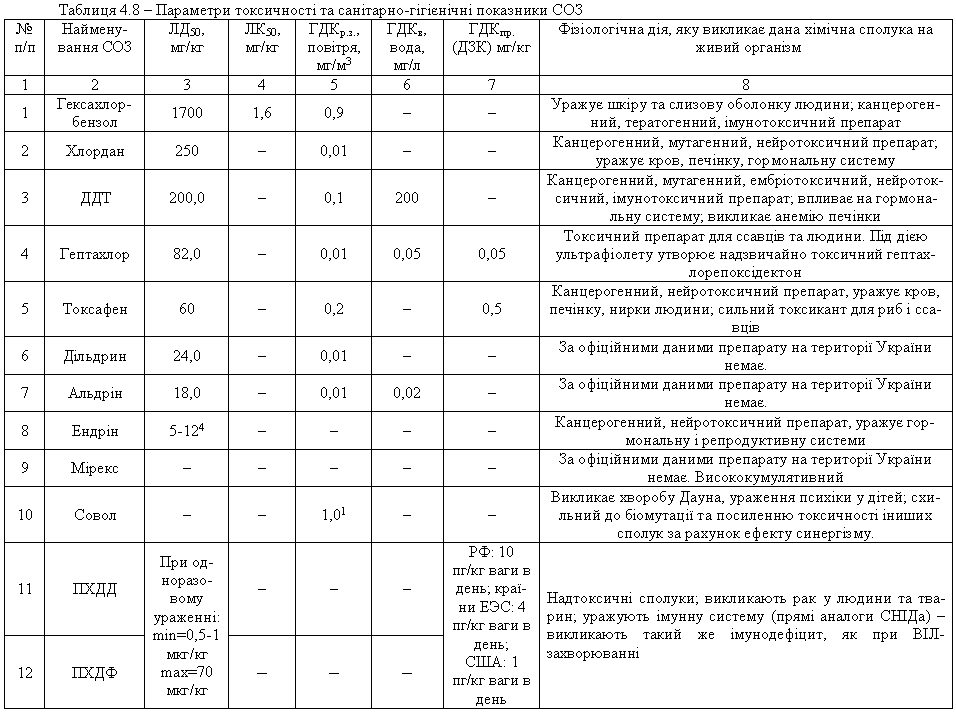 Примітки: ЛД50 – летальна доза токсичної речовини, що викликає при введенні її в організм загибель 50 % тварин, мг/кг, мг/л; ГДК р.з. – гранично допустима концентрація токсиканта в повітрі робочої зони, мг/м3; ГДКв – гранично допустима концентрація токсичного речовини в воді водоймища, мг/л; ГДКпр. (ДЗК) – гранично допустима концентрація (допустима залишкова кількість) хімічної сполуки в продуктах харчування, мг/кг, 1 пікограм (пг) = 1•10-12 грама. 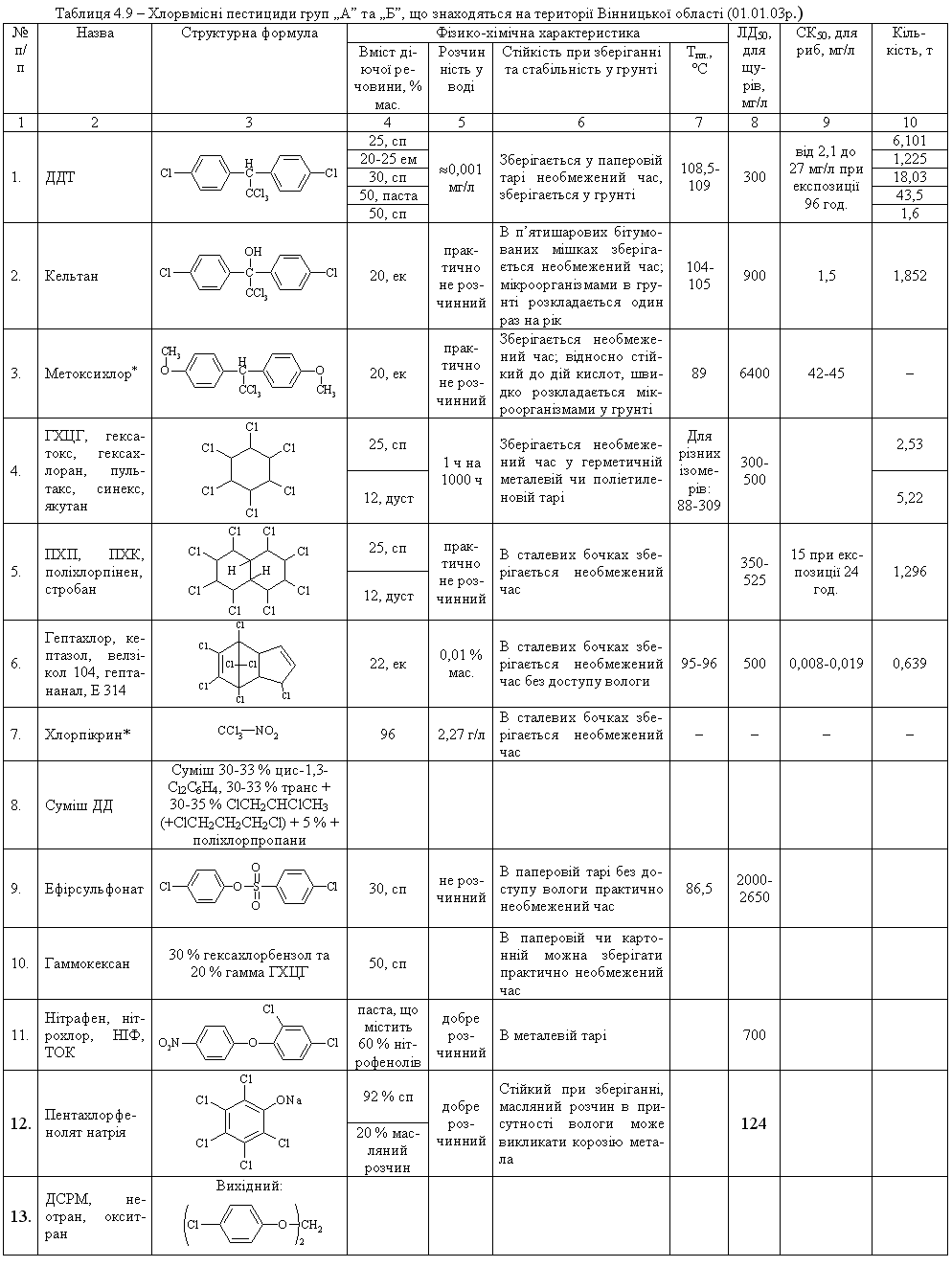 Технологічна схема переробки хлорорганічних відходів з використан-ням процесу „Транскат” 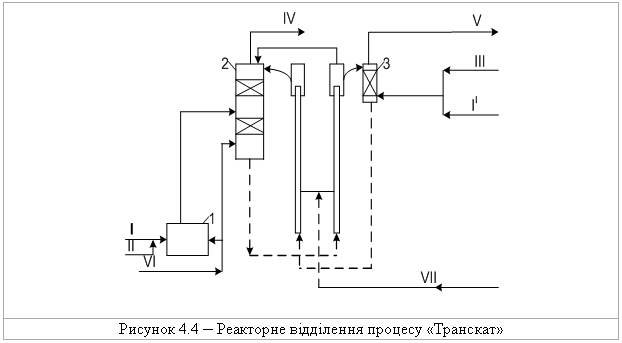 Устаткування: 1 – піч спалювання відходів; 2 – реактор окиснення; 3 – реактор оксихлоринолізу. Матеріальні потоки: І – висококиплячі відходи, І – низкокиплячі відходи, ІІ – паливо, ІІІ – НС1, Cl2, IV – абгази, V – вінілхлорид, VI – повітря, VII – газ-ліфт Процес „Транскат” використовують для добування вінілхлориду, або три- та перхлоретилену із різних хлорорганічних відходів. Вони пере-робляються одночасово в одному реакторному відділенні двома способа-ми: оксихлоринолізом та спалюванням при 1100С. В печі 1 спалюються відходи, що складаються з хлорованих смол та висококиплячих фракцій з утворенням НС1, Cl2 CO2. Гідрогенхлорид із печі 1, а також повітря над-ходять до реактора 2 протитоком до розплаву CuCl2, який надходить до реактора 3. Внаслідок поглинання гідрогенхлориду, хлору та кисню утво-рюється суміш розплаву, що складається з CuO-CuCl2-CuCl. Розплав на-правляється до реактора 3, де відбувається оксихлориноліз відходів, що складаються з із низькокиплячих відходів (дихлоретан, трихлоретан, перх-лоретилен, пентахлоретан). В процесі утворюється суміш вінілхлориду (чи органічних розчинників), побічних, непрореагованих продуктів та води. CuCl спрямовується до реактора 2. Техніко-економічні показники процесу „Транскат” такі: потужність за сировиною – 10,9 т/рік; хлорорганічні від-ходи – 1,053 т/рік; вихід продукту – 69,0 %. Енергетичні витрати на 1 кг відходів: вода – 297,2...141,7 л; пар – 3,1 кг; електроенергія – 2,4...3,0 кВтч; паливо – 721,5...123,5 ккал. Технологічна схема хлорування „важкого” залишку(1,2-дихлоретан та 1,2,2-трихлоретан) прямого хлорування етилену. Хімічні перетворення: 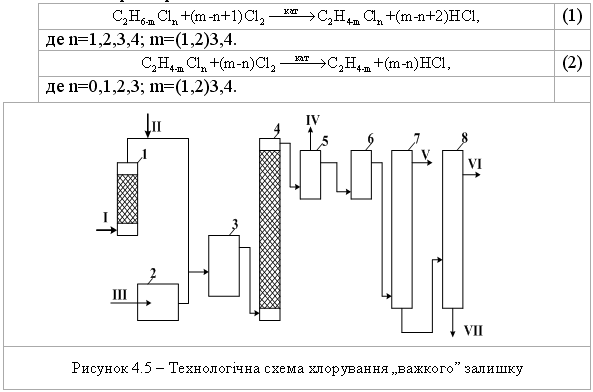 Устаткування: 1 – осушувач; 2 – жиник; 3 – випарник; 4 – реактор; 5, 6 – кон-денсатори; 7, 8 – ректифікаційні колони. Матеріальні потоки: І – хлор, ІІ – азот, ІІІ – «важкий» залишок, IV – абгази, V – трихлоретилен, VI – пентахлоретилен, VII – висококиплячі продукти.Рівняння (1) ілю-струє перетворення насичених, а рівняння (2) – ненасичених галогенопохідних. Каталізатор процесу хлорування – CuCl2-KCl-BaCl2, що нанесений на активоване вугілля, або Al2O3. Цей каталізатор може працювати при температурах до 500 С. Враховуючи це, температуру у зоні реакції під-тримують у інтервалі 475 480 С. Хлор, проходячи через осушувач 1, змішується із розбавником – азо-том чи повітрям. „Важкий” залишок із живника 2 надається до випарника 3, куди надходить також хлор та газ-розбавник. Із випарника суміш нада-ється до реактору 4, що заповнений каталізатором. Гази, які виходять із реактора, надходять до системи конденсації 5, 6 та потім на систему рек-тифікації 7,8. Технологічна схема безперервного процесу комбінованого піролізу хлорорганічних відходів Хімічні перетворення – дегідрохлорування з утворенням легких фра-кцій (газова фаза): 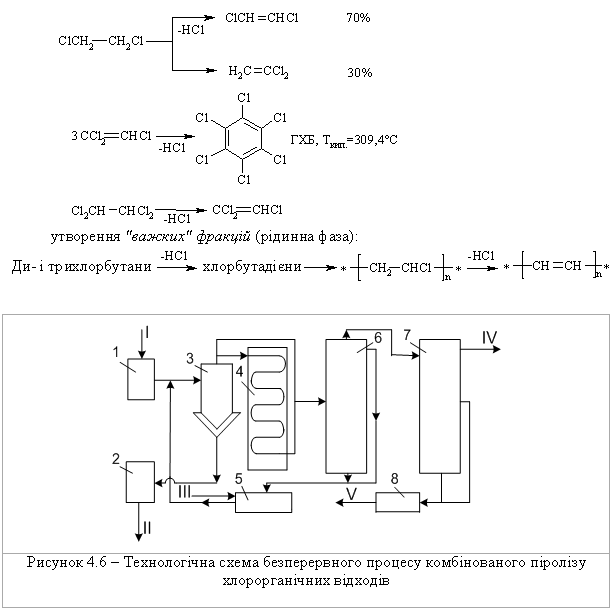 Устаткування: 1 – збірник відходів, 2 – збірник важких відходів, 3 – випарник – рідкофазний реактор, 4 – газофазний реактор, 5 – реактор полімеризації, 6 – закалю-вальний апарат, 7 – колона розділення, 8 – збірник. Матеріальні потоки: І – хлорорганічні відходи, ІІ – важкі відходи, ІІІ – А1С13, IV – 100 %-вый гідрогенхлорид, V – вінілхлорид та хлоретилени. Комбінованість процесу складається з того, що дегідрохлорування легких фракцій рідких відходів від виробництва вінілхлориду відбувається при більш високих температурах, ніж важких. Відходи І надходять до реактора-випарника 3, де відбувається піро-ліз рідкої фази та випарювання летких компонентів при температурі 95…115 С. Випарені компоненти (1,2-дихлоретан та 1,1,2-трихлоретан) надходять до реактора 4, де при 550…600 С відбувається дегідрохлору-вання. Суміш, що утворюється, надходить до закалювального апарату 6, де відбувається відокремлення HCl, вінілхлориду та дихлоретиленів від непрореагувавших та ненасичених продуктів. У колоні 7 вінілхлорид та дихлоретилени відокремлюються від гдірогенхлориду. Конденсат із зака-лювального апарату спочатку надходить до реактора полімеризації 5 для знижування коксоутворення у реакторі 4, а потім до випарника 3. Реактор 4 працює безперервно протягом тижня, потім його зупиняють для випалю-вання кокса. За цей час у рідкофазному реакторі-випарнику 3 відбувається накопичення важких фракцій та полімерів, які надходять до реактора 5. Далі у реактор 3 додають А1С13 (1...10 %), збільшують температуру до 220...600 С, внаслідок чого утворюються високомолекулярні тверді спо-луки, які містять 10 % хлору. Їх виводять із процесу та використовують у будівництві. Технологічна схема хлоринолізу хлорорганічних відходів виробницт-ва вінілхлориду та алілхлориду Хлориноліз – одночасне хлорування та піроліз відходів виробництва; якщо при цьому додається кисень, то процес називається оксихлоринолі-зом. Хімічні перетворення: процес складається із чотирьох стадій, які від-буваються одночасно: 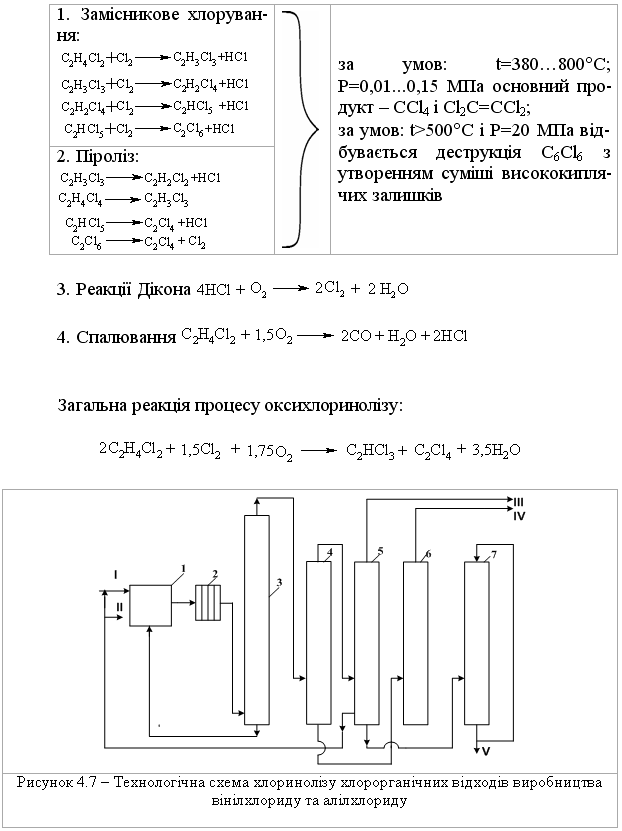 Матеріальні потоки: I – хлор, ІІ – хлорорганічні відходи, ІІІ – гідрогенхлорид, IV – СС14, V – розчин відпрацьованого лугу. Устаткування: 1 – реактор; 2 – холодильник; 3 – колона виділення висококип-лячих фракцій; 4 – колона виділення сирого ССl4; 5 – колона виділення НС1; 6 – коло-ни виділення ССl4; 7 – колона лужної промивки. Хлорорганічні відходи, свіжий та рециркулюючий хлор І надходять до реактора 1. У реактор з колони 3 надходять і висококиплячі продукти, що містять CCl4, C2Cl6 та C6Cl6. Температура процесу 500600С, тиск 20 МПа. Потім реакційні гази охолоджуються до температури 210С у холо-дильнику 2 та надходять до колони 3. У колоні 3 відбувається розділення легкокиплячих та висококиплячих фракцій. Висококиплячі фракції повер-таються на процес хлоринолізу, а легкокиплячі – надходять до колон 4-6, де відбувається розділення тетрахлорметану, гідрогенхлориду, хлору та фосгену. У колоні 7 відбувається нейтралізація (neutralization) відхідних газів водним розчином лугу. Конверсія хлорорганічних відходів досягає 95 %. Чистота тетрахло-рметану становить 99,0 %. На 1 т CCl4 утворюється 0,40,45 т гідрогенх-лориду. Технологічна схема „збалансованого” (безвідходного) процесу вироб-ництва вінілхлориду Хімічне перетворення. Вінілхлорид у промисловості добувають пі-ролізом дихлоретану: 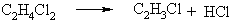 При збалансованому синтезі дихлоретану гідрогенхлорид, який ви-діляється в процесі піролізу дихлоретану, змішуюють з етиленом та на-правляють на окислювальне хлорування на каталізаторі (хлорид міді на носії): 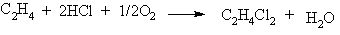 Єдиним продуктом даного процесу є вінілхлорид. Однак, змінюючи умо-ви, як побічні продукти добувають сухий гідрогенхлорид або дихлоретан, а інколи обидва продукти одночасно. 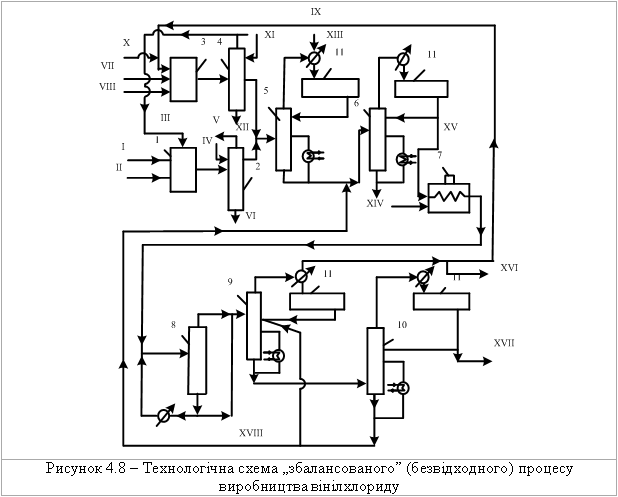 Устаткування:1 – реактор хлорування; 2, 4 – промивні колони; 3 – реактор ок-сихлорування; 5, 6 – ректифікаційні колони; 7 – піч крекінгу; 8 – колона закалювання, 9 – колона відгонки НС1; 10 – ректифікаційна колона. Матеріальні потоки: І, VII – етилен; ІІ – хлор; ІІІ – гази рециклу; IV, XI – роз-чин лугу; V – непрореагувавший етилен; VI, XII – відпрацьований розчин лугу; VIII – кисень; IX, XVI – гідрогенхлорид; XI11 – легкокиплячі домішки; XIV – важкі хлорор-ганічні відходи; XV – дихлоретан; XVII – вінілхлорид; ХVIII – кубова рідина. Суміш етилену І з хлором ІІ та газами рециклу ІІІ надходять до реак-тору прямого хлорування 1. Продукти хлорування промиваються розчи-ном лугу IV в колоні 2 для видалення непрореагувавшого хлору, тут же віддувається непрореагувавший етилен V. В реакторі 3 відбувається реак-ція оксихлорування етилену VII сумішшю сухого гідрогенхлориду ІХ та кисню VIII. Гідрогенхлорид, що виділяється, використовують у процесі крекінгу. Продукти оксихлорування промивають в колоні 4 розчином лугу ХІ від гідрогенхлориду. Несконденсований газ ІІІ спрямовують до реакто-ру прямого хлорування, а дихлоретан, добутий хлоруванням та оксихло-руванням, надають до ректифікаційних колон 5 та 6, у яких послідовно виділяють легкокиплячі домішки ХІІІ та важкі хлорорганічні відходи XIV. Очищений дихлоретан подають на крекінг до печі 7. Продукти крекінгу закалюють у колоні 8 та надають до колони 9, де відганяють сухий гідро-генхлорид, який або рециркулює до реактора оксихлорування, або відво-диться у вигляді готового продукту. Кубовий залишок колони 9 подають до ректифікаційної колони 10. Зверху відбирають вінілхлорид XVII, а ку-бову рідину ХVIII повертають до системи для виділення дихлоретану та важких хлорорганічних відходів. Як окисник на стадії оксихлорування використовують кисень повіт-ря або чистий кисень. Від цього залежить об’єм газів, які викидаються в атмосферу. Об’єм відхідних газів при використанні повітря, приблизно у 100 разів більший, ніж в процесах, де використовуються кисень. Очистка цих газів теж пов’язана з певними труднощами. Питання для самоконтролю 1. Навести схеми реакцій добування бензилхлориду та п-хлортолуолу з толуолу. Пояснити умови та механізми реакцій. Для бензилхлориду навес-ти схеми реакцій з водним розчином лугу, ціанідом калію, етилатом на-трію, аміаком. Пояснити механізм реакції гідролізу. 2. Навести схему реакції добування 1-хлор-2-бутену. Навести механізм та умови реакції гідролізу цього галогенопохідного. Назвати кінцевий про-дукт. 3. Встановити структурну формулу сполуки С6Н13Br, якщо внаслідок гід-ролізу утворюється третинний спирт, а при дегідробромуванні алкен, озо-нолізом якого добуто ацетон (СН3-СО-СН3) і пропаналь (СН3СН2СОН). Навести схеми відповідних реакцій та механізми гідролізу і дегідроброму-вання вихідної сполуки. 4. Встановити структурну формулу сполуки С3Н5Br, якщо вона легко реа-гує з водним розчином лугу та з аміаком. Навести схеми відповідних реак-цій та їх механізми. Запропонувати спосіб добування С3Н5Br. 5. Встановити структурну формулу сполуки С4Н9Br, яка при гідролізі утворює первинний спирт, а при дегідробромуванні та подальшому гідро-бромуванні - третинне галогенопохідне. Дати назву сполуці С4Н9Br. Наве-сти схеми відповідних реакцій та пояснити механізм гідролізу С4Н9Br. 6. Встановити структурну формулу сполуки С6Н13Cl, якщо при гідролізі вона утворює третинний спирт, а при дегідрохлоруванні – алкен, який при озонолізі утворює ацетон (СН3-СО-СН3) та пропаналь (СН3-СН2-СОН). Навести схеми відповідних реакцій. Запропонувати спосіб добування С6Н13Cl. 7. Сполука С8Н9Cl гідролізується водним розчином лугу в звичайних умо-вах, утворюючи сполуку С8Н10О, при окисненні якої утворюється фтальо-ва кислота (1,2-бензолдикарбонова кислота). Визначити будову сполуки С8Н9Cl. 8. Порівняти та пояснити швидкість реакцій гідролізу за механізмом SN1 для 2-метил-2-хлорбутану та 3-метил-3-хлор-1-бутену. Назвати схеми та механізми реакцій добування цих галогеноподібних. Навести схему реак-цій добування вінілхлориду та алілхлориду. Пояснити та порівняти їх бу-дову і реакційну здатність в реакціях нуклеофільного заміщення. Для алі-лхлориду навести схеми реакції з водним розчином лугу, цианідом калію, етилатом натрію, аміаком, пояснити механізм реакції гідролізу. 9. Пояснити будову молекул бензилхлориду, алілхлориду, вінілхлориду і хлорбензолу. Обґрунтувати, які з наведених сполук виявляють підвищену реакційну здатність в реакціях нуклеофільного заміщення. Навести для них схеми відповідних реакцій з водним розчином лугу, пояснити механі-зми. 10. Порівняти будову хлорбензолу і бензилхлориду. Яка з сполук виявляє знижену реакційну здатність в реакціях нуклеофільного заміщення? Для цієї сполуки навести реакцію гідролізу, пояснити умови і механізм.
Самостійна робота 1. Збірник тестових завдань з органічної хімії / Під ред. проф. Рансько-го А. П. – Дніпропетровськ, 2007. – С. 84-89. – ISBN 966-8018-54-0. Основна література 1. Гауптман З., Грефе Ю., Ремане Х. Органическая химия. – М.: Химия, 1979. –С. 283-301. 2. Ластухін Ю. О. Органічна хімія / Ю. О Ластухін, С. А. Воронов. – Львів: Центр Європи, 2001. – С. 281-307; С. 631-641. – ISBN 966-7022-19-6. 3. Черных В. П. Лекции по органической химии /В. П. Черных. – Харьков: Золотые страницы, 2005. – С. 146-163. – ISBN 966-615-155-3. Додаткова література 1. Грандберг И. И. Органическая химия / Грандберг И. И. – М.: Высшая школа, 1987. – С. 25-48. 2. Моррисон Р. Органическая химия / Моррисон Р., Бойд Р. – М.: Мир, 1974. – С. 11-31. 3. Штеменко Н. І. Органічна хімія та основи статичної біохімії / Штеменко Н. І., Соломко З. П., Авраменко В. І. – Дніпропетровськ. Видавництво ДНУ, 2003. – С. 210-232. – ISBN 966-551-117-3. 4. Проект № GF/2732-03-4668. «Забезпечення заходів із розроблення Наці-онального плану щодо впровадження у Україні Стокгольмської конвен-ції про стійкі органічні забруднювачі». Україна. Національний план ви-користання Стокгольмської конвенції про стійкі органічні забруднюва-чі. – Київ, 2006. – 279 с. 5. Стойкие органические загрязнители экосистемы / Ранский А. П., Кова-ленко В. С., Ткачук М. Ф. [та ін.] // Химия и хим. технология. – ISSN 0579-2921. 2006, № 5. – С. 239-245. 6. Охрана окружающей среды в нефтехимической и химической промыш-ленности / Под ред. проф. Мокрого Е. Н. – Львов: ЛГУ, 1989. – С. 123-141. 7. Гордон А. Спутник химика / Гордон А., Форд Дж. – М.: Химия, 1972. – 730 с. |