4.1.4 Хімічні властивості вуглеводнів Хімічні властивості алкілгалогенідів обумовлені реакціями за учас-тю С–Hal, С–Н та С–Н зв’язків за схемою: 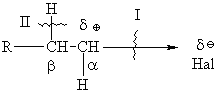 Велика електронегативність атомів галогенів (–І-ефект) обумовлює наявність позитивного заряду (електрофільного центру) на атомі Карбону С–Hal зв’язку, що і визначає основний тип реакцій галогенопохідних вуг-леводнів: І: нуклеофільне заміщення галогену (SN); – І + ІІ: іонне відщеплення НHal (a, -елімінування (Е)) за участю С–Н-зв’язку з утворенням алкену; характерні деякі реакції відновлення та реакції із активними метала-ми (Li, K, Na, Mg). Реакції нуклеофільного заміщення відбуваються з розривом зв’язку C–Hal за загальною схемою: 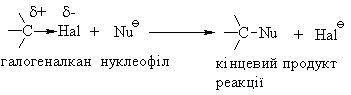 Реакції нуклеофільного заміщення здійснюються за такою схемою: 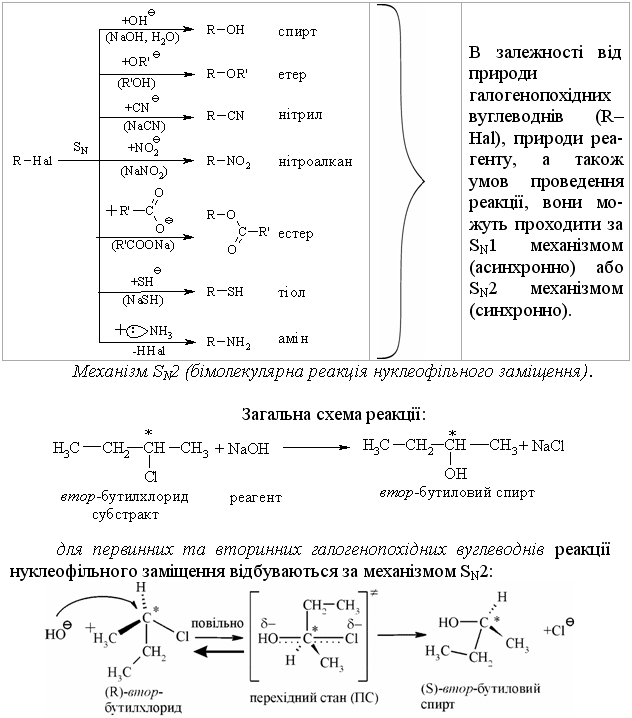 На рис. 4.1 наведено енергетичну діаграму реакції SN2. Швидкість цієї реакції відповідає реакції другого порядку: V=k•[CH3CH2CH(Cl)CH3][OH–]. Реакція бімолекулярна, тобто її швидкість залежить від концентрації як субстрату, так і реагенту. 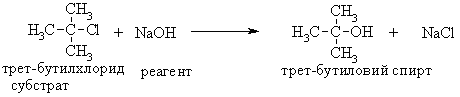 Для третинних галогенопохідних вуглеводнів реакція відбувається за механізмом SN1: 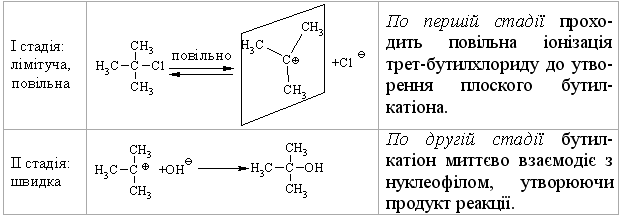 У тому випадку, коли заміщення відбувається біля асиметричного атома карбону (R R1 R2), то у процесі реакції SN1 утворюється суміш оптичних ізомерів (рацемат):  На рис. 4.2 наведена енергетична діаграма реакції SN1. Швидкість цієї реакції відповідає реакції першого порядку: V=k•[(CH3)3CСl]. Реакція мономолекулярна, тобто її швидкість залежить лише від концентрації суб-страту.Нуклеофільне заміщення (SN1 або SN2) біля насиченого атома кар-бону залежить від ряду факторів: структури субстрата (галогеналкана). Для первинних галогенопохі-дних вуглеводнів (R Hal) характерним є SN2-механізм. Із збільшенням роз-галуженості радикалу R переважає SN1 механізм, що пояснюється, по-перше, збільшенням стабільності карбокатіону, що утворюється, а, по-друге – утворенням просторових факторів для перебігу реакцій за механі-змом SN2 у випадку третинних галогеналканів. Тому для третинних гало-генопохідних вуглеводнів характерним є SN1-механізм. Часто механізми SN2 та SN1 конкурують; нуклеофільність реагента та його концентрація. Чим більшою є нуклеофільність реагента, тим більшою буде вірогідність перебігу реакції за SN2-механізмом. В той же час на реакції SN1 нуклеофільність реагента не має вирішальної дії, та реакції за цим механізмом відбуваються при дії слабких нуклеофілів. При цьому доцільно навести ряд відносної нуклео-фільності за рівнянням Свейна-Скотта: 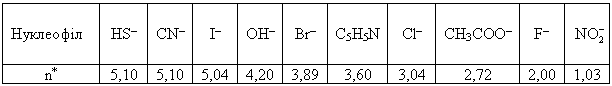 n* – відносна нуклеофільність реагента, (для Н2О, n=0). Окрім цього, високі концентрації реагента сприяють SN2-реакціям, а низькі – SN1. природа розчинника впливає на сольватацію вихідних сполук та іо-нів, що утворюються при іонізації галогенопохідних вуглеводнів. У випадку реакцій, які відбуваються за SN2-механізмом менш поля-рний перехідний продукт сольватується менше, ніж вихідні сполуки. То-му, із збільшенням полярності розчинника, швидкість таких реакцій зме-ншується. У випадку реакцій за SN1-механізмом при іонізації галогеналкану утворюється карбокатіон (третинна структура), стабілізація якого прохо-дить за рахунок сольватації тим більше, чим полярнішим є розчинник, що підвищує швидкість реакції. природа галогену, який заміщується, впливає на швидкість реакції пропорційно зменшенню поляризовності зв’язку С – Hal в ряду: R – I > R – Br > R – Cl > > R – F. Реакції нуклеофільного заміщення атома галогену, зв’язаного з аро-матичним ядром 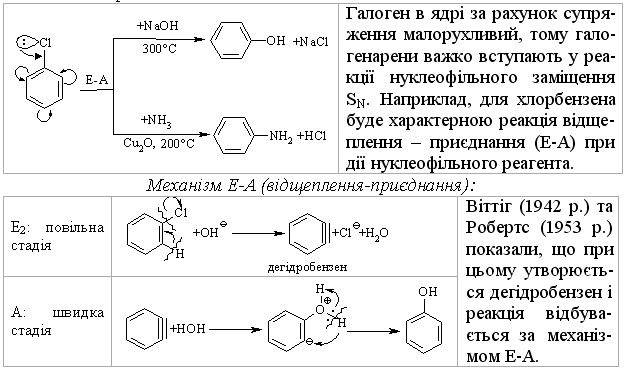 Це реакція другого порядку: V = k [C6H5Cl] [OH–]. Введення в ароматичне ядро сильних електроноакцепторних груп (– NO2, – COOH, – CN) значно полегшує реакцію нуклеофільного замі-щення, але при цьому змінюється її механізм: 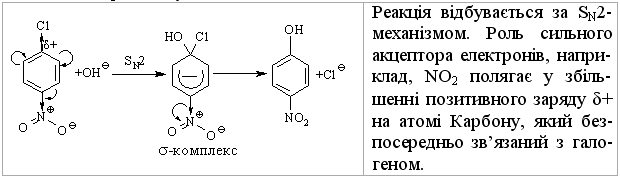 Реакції відщеплення (,-елімінування). Відщеплення (,-елімінування) – це реакція протилежна реакції приєднання за подвійним зв’язком: 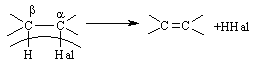 В залежності від природи субстрату та умов перебігу реакції вона відбувається за механізмом Е2 або Е1. Механізм Е2 (бімолекулярна реакція елімінування). Реакція характер-на для первинних галогеналканів. 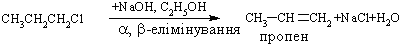 Реакція відбувається в присутності нуклеофільних реагентів, що мають високу основність: спиртовий розчин лугу (C2H5OH + NaOH), алко-голяти (alcoholate) лужних металів (RONa). Швидкість реакції збільшуєть-ся при нагріванні реакційної маси, або при використанні концентрованих розчинів вихідних сполук. 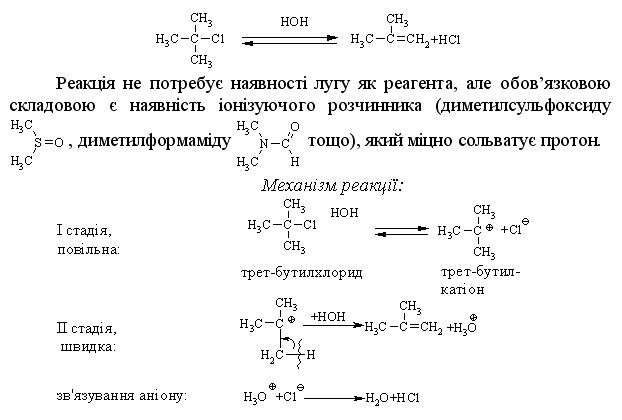 Нуклеофільний агент C2H5O– атакує -положення галогеналкану від-носно зв’язку C–Cl. При цьому відбувається відщеплення гідрогену від -Карбону, утворення алкену та відщеплення хлорид-аніону за синхронним механізмом. Механізм Е1 (мономолекулярна реакція елімінування). Реакція харак-терна для третинних галогенопохідних вуглеводнів. Загальна схема реакції: 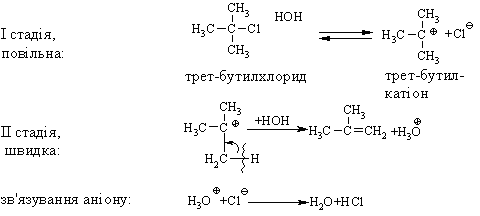 Реакція за механізмом Е1 є двохстадійною, а її швидкість визнача-ється рівнянням: V = k•[(CH3)3CСl]. Відщеплення галогеноводню відбувається за правилом Зайцева: гід-роген відщеплюється від сусіднього із галогеном, найменш гідрогенізова-ного атома карбону. 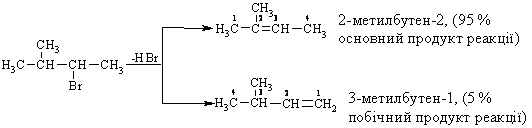 Порівняння умов перебігу реакцій SN1, SN2, Е1 та Е2 наведено у табл. 4.5. Наведені дані наочно свідчать, що реакції SN1 конкурують із реакція-ми Е1, тоді як реакції SN2 – із реакціями Е2, за такою схемою: 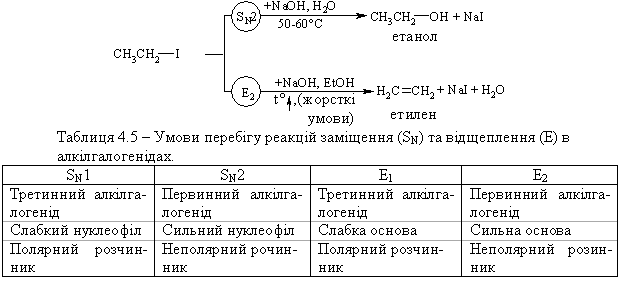 Із табл. 4.5 можна зробити такі загальні висновки: Реакції SN2 характерні для первиних алкілгалогенідів, при дії силь-них нуклеофілів в апротоних розчинниках та помірних температурах. Реакції SN1 характерні для третиних алкілгалогенідів, при дії слаб-ких нуклеофілів в протоних розчинниках. Для добування аленів використовуют Е2 реакції, тому що вони від-буваються швидше, з більшим виходами, не супроводжуються перегрупу-ванням порівнянно з Е1 реакціями. Для здійснення реакцій Е2 використо-вують спиртовий розчин лугу та підвищену температуру (жорсткі умови). Чим сильнішою є основа, тим більш імовірною буде реакція відщеп-лення (елімінування) Е2 типу в порівнянні з SN2 реакціями. Підвищення температури збільшує частку продуктів відщеплення за рахунок зниження частки продуктів заміщення. На відміну від реакції SN1 та SN2 реакційна здатність галогеналканів для реакцій Е1 та Е2 зменшується у ряду: третинні > вторинні > первинні. Взаємодія галогенопохідних вуглеводнів з металами (Li, K, Na) роз-глядалась на прикладі реакції Вюрца (тема „Алкани”). Змінюючи умови реакції для тих же вихідних речовин можна отримати металоорганічні сполуки: 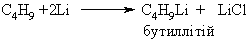 При використанні магнію, утворюються магнійорганічні сполуки (реактиви Гріньяра): 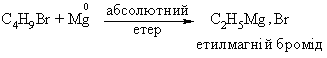 які надзвичайно поширні у препаративному синтезі багатьох класів орга-нічних сполук. |