4.1.3 Характеристика зв’язків карбон–галоген С–Hal 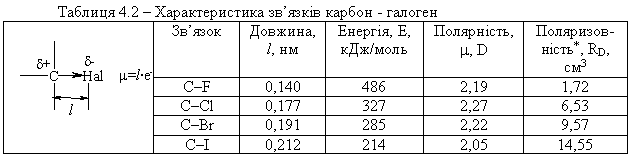 Примітка: * RD – коефіцієнт атомної рефракції, розрахований з пока-зника заломлення для D-лінії спектру натрію [7]. Галогеналкани – полярні сполуки, які характеризуються значним дипольним моментом. Дипольні моменти та ступінь полярності зв’язків С–Hal є тим більшою, чим більшою є електронегативність галогену. Виня-тком є зв’язок C–F та C–Cl, що пояснюється збільшенням довжини зв’язку при переході від елементу другого періоду до елементу третього періоду. Поляризовність збільшується пропорційно зменшенню електронега-тивності галогенів. Хімічні властивості галогенопохідних вуглеводнів за-лежать як від поляризації, так і від поляризовності зв’язків і, насамперед, зв’язку С–Hal (табл. 4.3). Серед багатьох факторів, що впливають на поля-ризацію та поляризовність, заслуговують на увагу такі, як природа галоге-ну і тип гібридизації атома карбону, природа атакуючої частинки, розчин-ника, умов каталізу тощо. 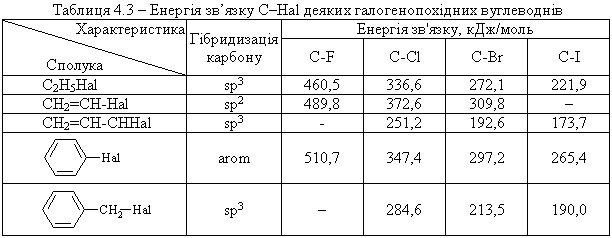 Довжина зв’язку С–Hal галогенопохідних вуглеводнів в залежності від природи галогену та типу гібридизації атому карбону, з яким сполуче-ний галоген, та дипольні моменти відповідних зв’язків наведені у табл. 4.4.  Висновки із даних, наведених в табл. 4.3-4.4: галогенопохідні вуглеводнів мають високу реакційну здатність за винятком фторпохідних. Висока енергія зв’язку C–F (486 кДж/моль) та ни-зька поляризовність (1,72 см3) обумовлює пасивність цих сполук в хіміч-них реакціях; для зв’язку С–Hal характерне гетеролітичне розщеплення за схемою: 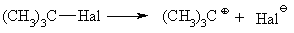 легкість розриву зв’язку С–Hal закономірно збільшується від фтор- до йо-дпохідних в порядку зменшення електронегативності галогенів. |