4.2.5 Екологічні питання Екологічні питання хімії спиртів та фенолів пов’язані з їх виробниц-твом та використанням, наприклад, в синтезі естерів ортофосфорної та тіофосфорної кислот, які у великих кількостях використовуються як інсек-тициди (досліджено близько 100 тис. сполук майже для кожного типу ко-мах): 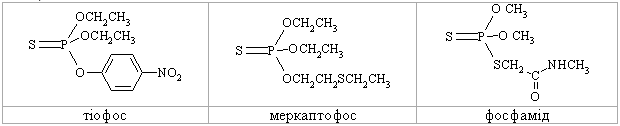 Дія естерів ортофосфорної та тіофосфорної кислот полягає в фосфо-рилюванні і блокуванні фермента ацетилхолінестерази. Більшість інсекти-цидів вже зняті із виробництва та заборонені до використання, але знахо-дяться на всій території України в несанкціонованих умовах зберігання, і є високотоксичними речовинами не лише для комах та тварин, а і для лю-дини. Наведені у табл. 4.15 сірко- та фосфорвмісні пестицидні препарати використовувались у колишньому СРСР як інсектициди. На сьогодні бі-льшість з них заборонена до використання, а залишки (~20 тис. т, перева-жно змішані та неопізнані, категорії В) знаходяться в несанкціонованих умовах зберігання по всій території України, створюючи при цьому значне екологічне напруження для населення. Знезараження пестицидних препаратів. Спеціальні дослідження по реагентному або термічному знезара-женню сірко- та фосфорвмісних пестицидних препаратів не проводились. Суттєву інформацію стосовно їх реагентного знезараження можна отрима-ти із загальної схеми їх промислового виробництва: 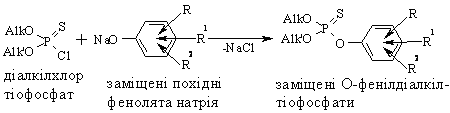 Така схема передбачає, що при нагріванні лужних розчинів інсекти-цидні фосфоровмісні органічні препарати повинні легко гідролізуватися за схемою: 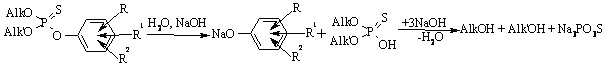 Інші сірко- та фосфорвмісні препарати категорій „А” і „Б”, які зберігають-ся у Вінницькій області і можуть бути знезаражені реагентними методами, наведено у табл. 4.15. 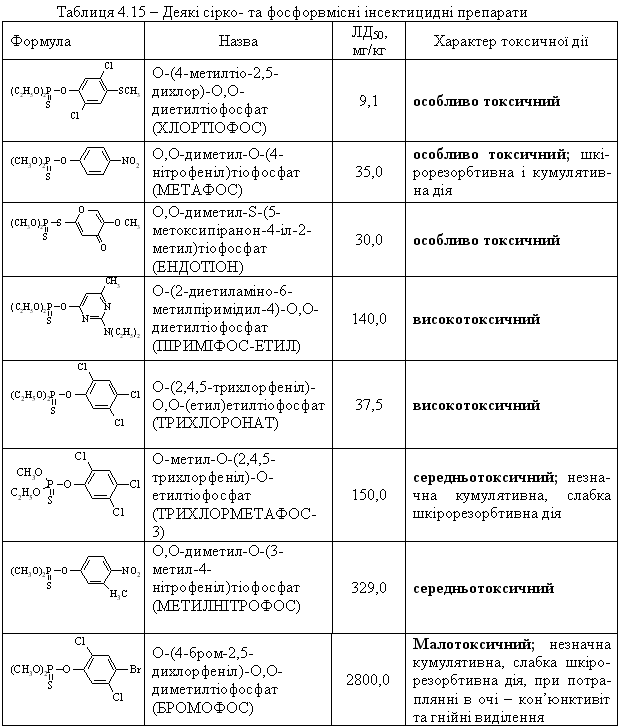 Запобіжні заходи при роботі із сірко- та фосфорвмісними пестици-дними препаратами: слід працювати в лабораторії з потужною примусо-вою вентиляцією; мати спеціальний одяг та фільтруючий протигаз із від-повідною маркою фільтруючої коробки; слід уникати потрапляння на шкі-ру, слизові оболонки, особливо у очі та дихальні шляхи токсичних речо-вин, при потраплянні негайно змити великою кількістю холодної води. Серед інших токсичних сполук слід відзначити метанол, фенол та крезоли, які широко застосовуються в хімічній, нафтодобувній та нафто-хімічній промисловості. Виходячи з цього, наведемо найважливіші сполу-ки із класу спиртів та фенолів. Метанол. Отрута, його вживання в кількості 25 мл обумовлює слі-поту, 30 мл – смерть. Токсичність метанолу пов’язана з біологічним окис-ненням в живому організмі до формальдегіду. Як протиотруту використо-вують розчин лактату натрію. Метанол окиснюють до формальдегіду; застосовують в синтезі чи-сельних органічних сполук, а також як розчинник. Етанол. Дуже поширений із давніх часів як складова частина усіх алкогольних напоїв, з водою змішується у всіх співвідношеннях. Невелика кількість етанолу, що потрапляє в організм людини, викликає збудження (або навпаки гальмування), більша кількість має наркотичний або навіть токсичний вплив. Летальна доза чистого спирту складає 300 г. Зазвичай концентрація етанолу в крові людини складає 0,001 %. При вживанні ал-коголю його концентрація швидко зростає і досягає максимуму приблизно через 1,5 години. На людину алкоголь діє не однозначно, але при його концентрації в крові людини 0,1 % наступає збудження, 0,2 % – відповідає сп’янінню середнього ступеня, а 0,3 % – алкогольному отруєнню. Для лі-кування від алкоголізму використовують спеціальні препарати на основі N,N,N,N-тетраетилтіурам-органічних речовин, а останнім часом – як альтернативне біопаливо для двигунів внутрішнього згоряння ("Біотопливо"). Технологічна схема виробництва етилового спирту 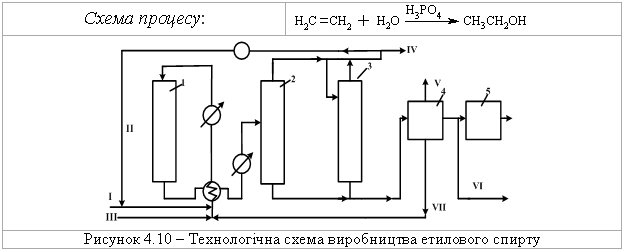 Устаткування:1 – реактор гідратації; 2 – сепаратор; 3 скрубер; 4 – ректифіка-ційна колона; 5 – дегідратор. Матеріальні потоки: І – свіжий етилен, ІІ рециркулюючий етилен, III – демі-нералізована вода,IV – гази віддувки, V легкокиплячі домішки, VI – азеотропна су-міш, VII – кубовий залишок. Свіжий етилен І змішується із рециркулюючим етиленом та деміне-ралізованою водою ІІІ, нагріваючись у теплообміннику, подається до се-парататора 2, в якому газ відокремлюється від конденсату. Потім газ про-мивають водою у скрубері для уловлення пари етилового спирту і частину подають на віддувку IV, а залишок ІІ повертають до реактору І. Водний розчин етанолу із сепаратора та скрубера подається до ректифікаційної колони 4, де із нього видаляють легкокиплячі домішки V та відганяють азеотропну суміш VI, яка містить 95 % етилового спирту та 5 % води. Кубовий залишок містить, в основному, воду, яку повертають у про-цес. Із легкокиплячих фракцій видаляють діетиловий етер, який або повер-тають до реактора для підвищення виходу етанолу, або відводять у вигляді готового продукту. Частину азеотропної суміші спрямовують до дегідра-тора 5 для добування безводного етилового спирту. Технологічна схема виробництва ацетону та фенолу 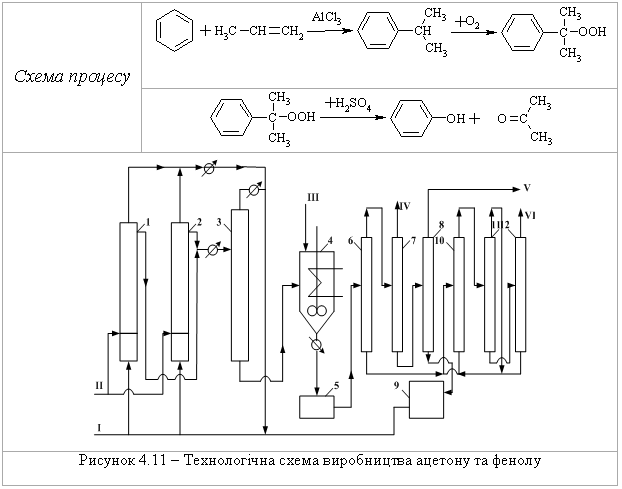 Устаткування: 1, 2 – реактори окиснення; 3 – концентраційна колона; 4 – апарат розкладання гідропероксиду; 5 – промивач; 6-8 – ректифікаційні колони; 9 – апарат для очистки ізопропілбензену; 10-12 – ректифікаційні колони; Матеріальні потоки: І – ізопропілбензол; ІІ – повітря; ІІІ – кислотний каталізатор; ІV – легко киплячі речовини; V – ацетон; VІ – фе-нол. Ізопропілбензол І окиснюють повітрям ІІ в двох паралельно працю-ючих реакторах 1 та 2. Гідропероксид потім концентрують у колоні 3. Лег-кокиплячі речовини повертаються назад на окиснення, а кубова рідина, що містить 80 % гідропероксиду, надходить до апарату 4, де під дією кислот-ного каталізатору ІІІ відбувається її розклад. Суміш продуктів потім нада-ється на виділення каталізатора у апарат 5. Органічну фазу розділяють у колоні 6. Зверху виділяють ацетон-сирець, а у кубі концентрується фенол. Із ацетону-сирця у ректифікаційній колоні 7 виділяють легкокиплячі речо-вини ІV, а у колоні 8 добувають товарний ацетон V та непрореагувавший ізопропілбензол, який після очистки у апараті 9 повертається назад на окиснення. Фенол VІ добувають у ректифікаційних колонах 10-12. Конве-рсія ізопропілбензолу складає 95 %. Щоб отримати 1 т фенолу, необхідно затратити 1345 кг кумолу, при цьому утворюється 600 кг ацетону. Питання для самоконтролю 1. Заповнити схему перетворень і назвати продукти: 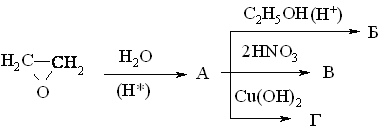 Де використовуються сполуки А, Б, В? 2. Навести структурну формулу сполуки С4Н10О, яка реагує з металічним натрієм з виділенням водню, а при окисненні утворює кетон. Назвати цю сполуку і навести схеми відповідних реакцій. 3. Описати структуру сполуки С4Н8О, яка знебарвлює бромну воду, реагує з металічним натрієм з виділенням водню, а при обережному окисненні утворює вінілоцтовий альдегід. Назвати цю сполуку, навести схеми відпо-відних реакцій, а також схему добування С4Н8О із пропілену через магні-йорганічну сполуку. 4. Навести можливу структурну формулу сполуки С7Н16О, яка має такі властивості: а) при дії СН3МgI виділяє метан; б) при дегідратації утворює вуглеводень С7Н14, який при озонолізі дає суміш оцтового та ізовалеріано-вого альдегідів. Назвати цю сполуку і навести схеми відповідних реакцій. 5. За допомогою яких реакцій можна перевести етилен в динітрат етилглі-колю і етилцелозольв? Навести схеми цих реакцій. Де використовуються дані сполуки? 6. За яким механізмом (SN1 чи SN2) відбуваються реакції 1-пропанолу, 3-метил-3-пентанолу і 2-пентанолу з бромводневою кислотою?Для якого спирту найбільш вірогідною є конкуруюча реакція елімінування водою Е1? Навести схеми всіх реакцій та пояснити їх механізми. 7. Продукт дегідратації 2-пентанолу був окислений розведеним водним розчином перманганату калію (реакція Вагнера). Продукт оброблено оц-товим ангідридом. Навести схеми всіх реакцій, назвати продукт. 8. Використовуючи магнійорганічний синтез, отримати 2-метил-3-пентанол, та дегідратувати його. Продукт дегідратації окисник розведений водним розчином перманганату калію. Навести механізм дегідратації. 9. Навести схеми добування гліцерину із пропілену та написати для гліце-рину реакції з оцтовою та нітратною кислотами. Назвати продукти реакції. 10. Спирт С7Н16О вступає в реакцію естерифікації, при нагріванні з АI2О3 утворює сполуку С7Н14, озонолізом якої добувають метилетилкетон та пропіоновий альдегід. Встановити будову спирту і назвати його. Навести схеми всіх реакцій та всі відомі способи добування спирту С7Н16О.
Самостійна робота 1. Збірник тестових завдань з органічної хімії / Під ред. проф. Рансько-го А. П. – Дніпропетровськ, 2007. – С. 98-107. – ISBN 966-8018-54-0. Основна література 1. Гауптман З., Грефе Ю., Ремане Х. Органическая химия. – М.: Химия, 1979. –С. 302-331. 2. Ластухін Ю. О. Органічна хімія /Ю. О Ластухін, С. А. Воронов. – Львів: Центр Європи, 2001. – С. 309-340; С. 684-709. – ISBN 966-7022-19-6. 3. Черных В.П. Лекции по органической химии / В.П. Черных. – Харьков: Золотые страницы, 2005. – С. 201-240. – ISBN 966-615-155-3. Додаткова література 1. Грандберг И. И. Органическая химия / Грандберг И. И. – М.: Высшая школа, 1987. – С. 222-242. 2. Моррисон Р. Органическая химия / Моррисон Р., Бойд Р. – М.: Мир, 1974. – С. 476-493; 500-516; 750-768. 3. Штеменко Н.І. Органічна хімія та основи статичної біохімії / Штеменко Н. І., Соломко З. П., Авраменко В. І. – Дніпропетровськ. Видавництво ДНУ, 2003. – С. 233-266. – ISBN 966-551-117-3. 4. Мельников Н. Н. Пестициды. Химия, технология, применение / Мель-ников Н. Н. – М.: Химия. – 712 с. 5. Мельников Н. Н. Технические средства защиты растений. Справочник / Мельников Н. Н., Новожилов К.В., Пылова Т. Н. – М.: Химия, 1980. – 288 с. |