4.2.4 Хімічні властивості спиртів та фенолів Завдяки різній будові хімічні властивості аліфатичних спиртів сут-тєво відрізняються від хімічних властивостей фенолів. Тому реакції, що характерні для цих сполук розглянемо окремо. Реакції, характерні для аліфатичних спиртів, можна позділити на 3 групи:  реакції окиснення, в яких беруть участь одночасно гідроксильна група та атоми гідрогену, що знаходяться у -положенні відносно гідро-ксильної групи. Реакції, що відбуваються за участю атома гідрогену гідроксильної групи. Кислотно-основні властивості спиртів обумовлені наявністю гідро-ксильної групи ОН та її здатністю дисоціювати з утворенням алкоголят-аніонів: 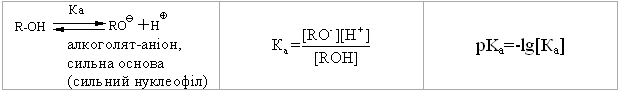 За своїми кислотними властивостями спирти є більш слабкими кис-лотами порівняно з водою, фенолами та карбоновими кислотами, але більш сильними кислотами, порівняно з ацетиленом і аміаком (табл. 4.13). 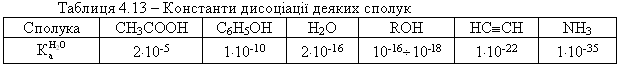 Слід відзначити, що в залежності від природи розчинника (апротон-ний, протонний) та агрегатного стану (розчин, газова фаза) відносна кис-лотно-основна сила сполук, включаючи і спирти, в конкретних реакційних серіях може змінюватись, що визначається складним диференцюючим та інтегруючим характером взаємодії в системі: „кислота-розчинник”. В залежності від будови спиртів, кислотність зменшується у ряду: 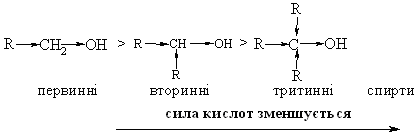 Це пояснюється +І-ефектом алкільних груп R, внаслідок якого поля-рність зв’язку С–О зростає, а полярність зв’язку О–Н навпаки зменшуєть-ся, що і обумовлює зменшення кислотних властивостей. Замісники із –І-ефектом, навпаки, збільшують полярність зв’язку О–Н, що приводить до збільшення кислотних властивостей: 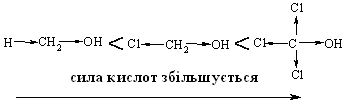 Так, для трихлорметанолу характерні високі кислотні властивості. Спирти належать до амфотерних сполук, що підтверджується насту-пними реакціями: Кислотні властивості спиртів характеризуються їх взаємодією із активними металами (Na, K, Mg, Al): 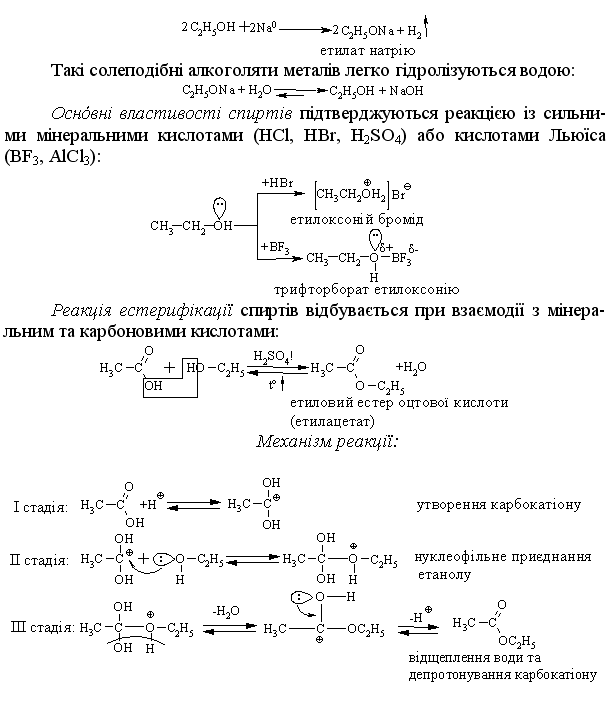 За механізмом – це бімолекулярна реакція приєднання, яка має ряд особливостей: реакція рівноважна, тому для добування кінцевого естеру з макси-мальним виходом необхідно або створювати значний надлишок вихідних речовин, або виводити із реакційного середовища воду та кінцевий естер; швидкість реакції для спиртів різної будови змінюється у ряду: Vперв.:Vвтор.:Vтрет.=20:3:1. В першому наближенні це можна пояснити стери-чними перешкодами. 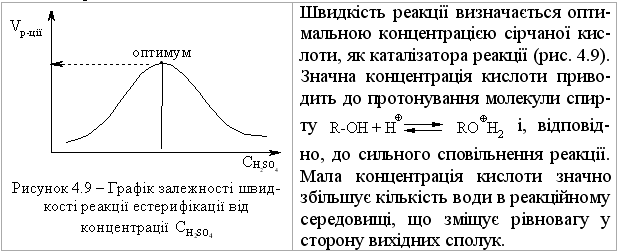 Реакції, що відбуваються із заміщенням або відщепленням гідрокси-льної групи. Нуклеофільне заміщення гідроксилу на галоген відбувається при дії галогенідів фосфору та сірки, а також галогеноводнів H-Hal (HI>HBr>HCl) за схемою: 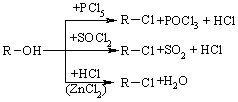 Реакції, що відбуваються із заміщенням або відщепленням гідрокси-льної групи. Нуклеофільне заміщення гідроксилу на галоген відбувається при дії галогенідів фосфору та сірки, а також галогеноводнів H-Hal (HI>HBr>HCl) за схемою: 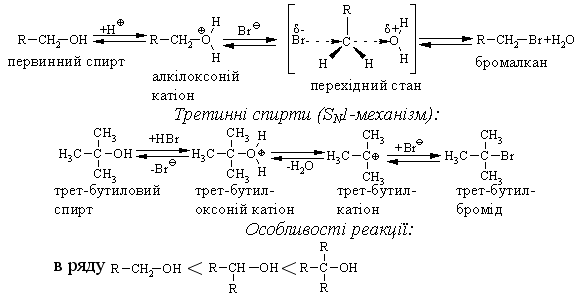 оснóвні властивості спиртів збільшуються, тому є закономірним зростання швидкості реакції у тій же послідовності (з урахуванням прото-нування спиртів на першій стадії); для спиртів, у порівнянні із галогеналканами, більш характерним є механізм SN1, тому що нейтральна молекула води (Н2О) відщеплюється значно легше, ніж заряджений галогенід-аніон (Hal–): 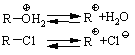 Дегідратація спиртів. Розрізняють міжмолекулярну та внутрішньомолекулярну дегідрата-цію спиртів: 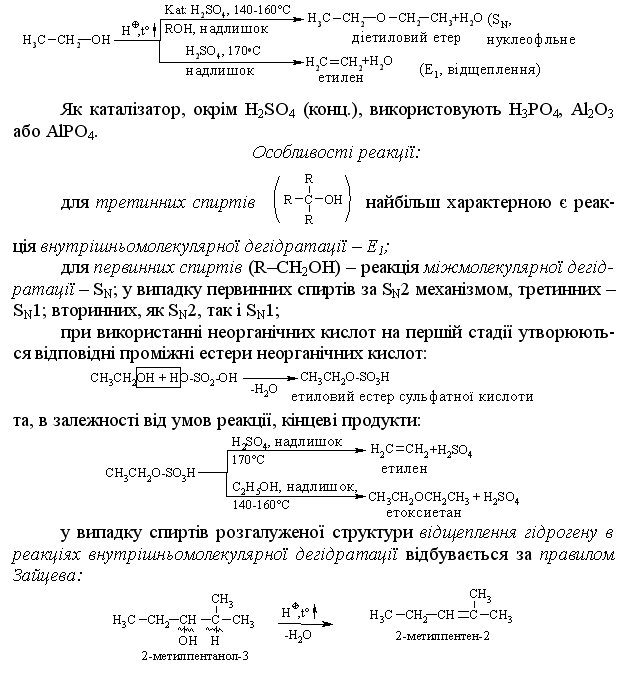 Окиснення спиртів проводять, як правило, сильними окисниками: (K2Cr2O7+H2SO4), CrO3, (KMnO4+H2SO4), киснем повітря (у промисловос-ті). При цьому окиснюється атом карбону, який безпосередньо зв’язаний із гідроксильною групою, тому в залежності від будови спирту (первинний, вторинний або третинний), утворюються різні продукти реакції. Первинні спирти окиснюються до альдегідів, які в подальшому лег-ко утворюють відповідні карбонові кислоти: 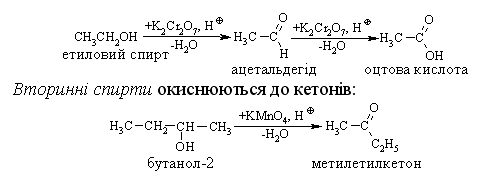 Третинні спирти окиснюються в жорстких умовах спочатку з утво-ренням алкенів, а потім, з розривом подвійного зв’язку, до кетонів та кар-бонових кислот з меншим, ніж у молекулі вихідного спирту, числом ато-мів карбону: 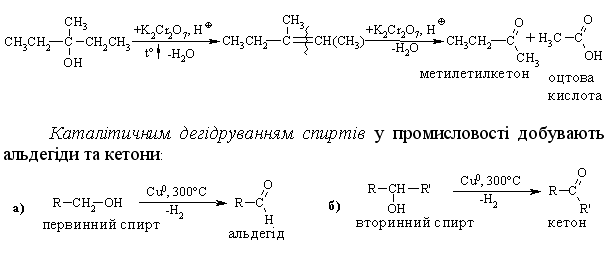 Хімічні властивості фенолів. Хімічні реакції фенолу можна поділити на дві групи: реакції, що відбуваються за участю гідроксильної групи; реакції, що відбуваються за участю ароматичного ядра. Реакції за участю гідроксильної групи. Супряження неподільної па-ри електронів атома оксигену гідроксильної групи з 6-електронною гус-тиною бензольного ядра приводить до сильної поляризації зв’язку О-Н. При цьому атом гідрогену гідроксильної групи стає рухливим та досить легко заміщується на інші атоми або атомні групи, виявляючи кислотні властивості. З іншого боку, наявність +М-ефекту гідроксильної групи при-водить до скорочення зв’язку С–ОН, що робить практично неможливим реакції заміщення гідроксилу. Фенол дисоціює по кислотному типу з утворенням досить стабільно-го фенолят-аніону: 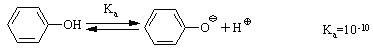 Порівняння констант дисоціації фенолу та аліфатичних спиртів (10-16–10-18) вказує на те, що фенол є значно сильнішою кислотою. Тому для нього характерною є класична реакція нейтралізації: 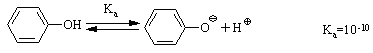 Вплив замісників у бензольному ядрі на кислотні властивості фено-лу має таку ж закономірність (І-ефект), що і для аліфатичних спиртів (табл. 4.14): 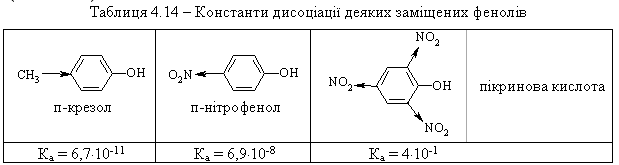 При цьому можна константувати, що замісники із –І-ефектом (-NO2) збільшують кислотні властивості фенолів, а із +І-ефектом (-СН3), відпові-дно, зменшують силу кислот. Нуклеофільне заміщення гідроксогрупи не характерне для фенолів, на відміну від аліфатичних спиртів: 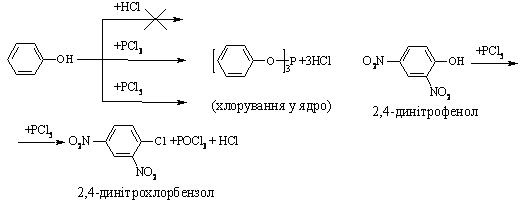 Воно стає можливим лише при активуванні бензольного ядра вве-денням електроноакцепторних замісників, наприклад, NO2. Утворення етерів та естерів фенолу відбувається значно важче, ніж у випадку аліфатичних спиртів. У звичайних умовах стають не мож-ливими хімічні реакції з кислотами та фенолами. Для здійснення таких ре-акцій необхідно активувати реакційні центри вихідних сполук, перетво-рюючи їх в сполуки із іонним або більш полярним зв’язком: 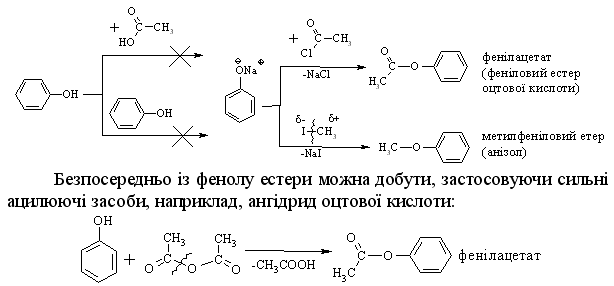 Реакції, що відбуваються по ароматичному ядру. Гідроксильна гру-па є електронодонорним замісником (+М-ефект) і в реакціях електрофіль-ного заміщення (SE) збільшує швидкість реакції та спрямовує електрофі-льний реагент переважно в орто- та пара-положення. Галогенування. Фенол легко реагує з бромною водою, утворюючи 2,4,6-трибромфенол: 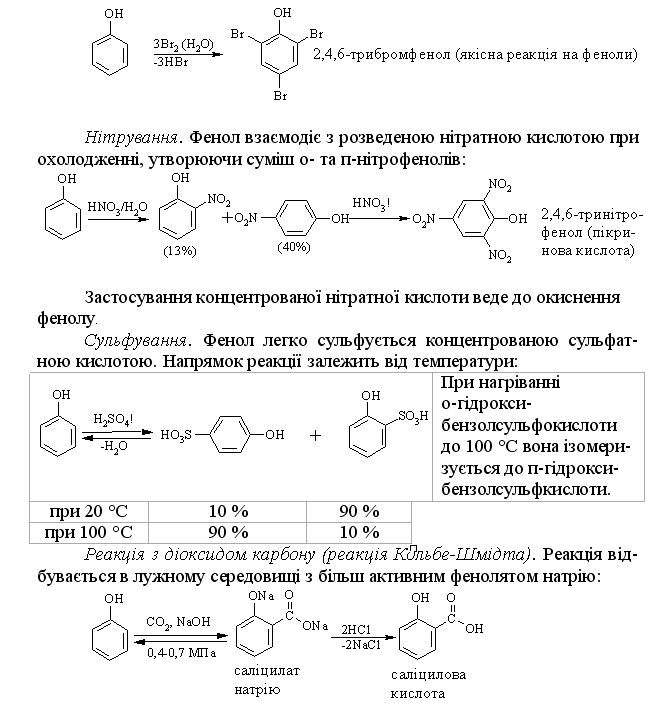 Конденсація з альдегідами та кетонами. Конденсація фенолу з фо-рмальдегідом у кислому середовищі лежить в основі добування фенолфо-рмальдегідних смол. Причому, при надлишку фенолу утворюються ново-лачні смоли: 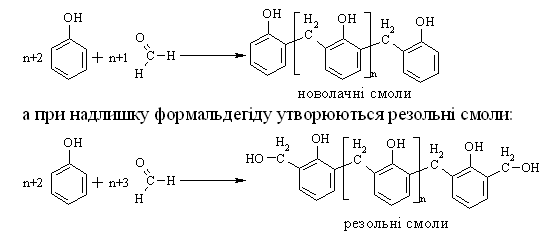 При конденсації фенолу з ацетоном утворюється біс-фенол А, який широко використовується для синтезу поліконденсованих полімерів, на-приклад, полікарбонату, епоксидних смол, тощо: 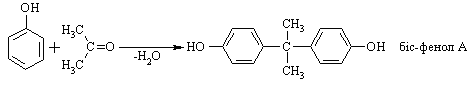 |