4.3.4 Хімічні властивості етерів Реакційна здатність етерів досить низька. Навіть при нагріванні вони не взаємодіють із водою, лугами та розбавленими кислотами. Утворення оксонієвих солей було розглянуто раніше. Можна лише додати, що при дії алкілфторидів на етерати трифтористого бору утворю-ються солі Мейєрвейна, (1937 р.): 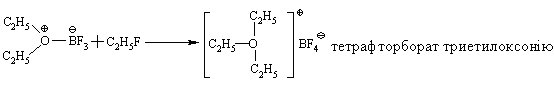 Такі сполуки легко відщеплюють алкіл-катіон і тому виступають прекрасними алкілуючими агентами по відношенню до нуклеофільних субстратів: 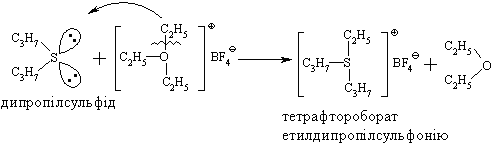 Розщеплення етерів. Діарилові етери стійкі до дії концентрованих кислот: НІ та HBr, в той час, як діалкілові та алкіларилові етери уже при кімнатній температурі розщеплюються з утворенням алкілгалогенідів і спиртів (фенолів): 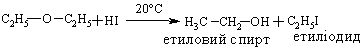 Якщо суміш, що при цьому утворилась, нагрівати із надлишком кис-лоти, то спирт переходить в галогеналкан: 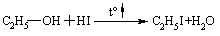 Такий процес розщеплення етерів використовують для кількісного визначення метокси- або етоксигруп по Цейзелю. Етери при дії лужних металів (Li, K, Na) розщеплюються із утворен-ням алкоголятів металів і металоорганічних сполук: 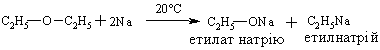 Автоокиснення етерів. При довгому зберіганні на повітрі під впли-вом світла етери утворюють нестійкі та вибухонебезпечні гідропероксиди та пероксиди: 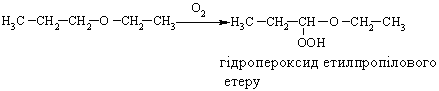 Такі малолеткі маслянисті рідини накопичуються у залишку (кубі) при прямій перегонці етерів, тому перед використанням етерів слід обов’язково робити пробу на наявність у їх складі пероксидних сполук:  Якщо реакція позитивна, то молекулярний йод з розчином крохмалю утворює синє забарвлення реакційної маси, а самі пероксидні сполуки ете-ру необхідно відновити, обробляючи його металевим натрієм, або солями Fe(II), Mn(II). Оксид етилену (етиленоксид, оксиран). Циклічні етери будуть розглянуті на прикладі оксиду етилена, який суттєво відрізняється по своїй реакційній здатності від інших циклічних етерів. Оксид етилену отримують, здебільшого, окисненням етилену або дегідрогалогенуванням етиленхлоргідрину:  Розрив зв’язку С–О та утворення наведених раніше кінцевих сполук може відбуватись синхронно за механізмом SN2 або в дві стадії за механіз-мом SN1. Так, у кислому середовищі реакція нуклеофільного заміщення (SN1) з розривом зв’язку С–О проходить у дві стадії: 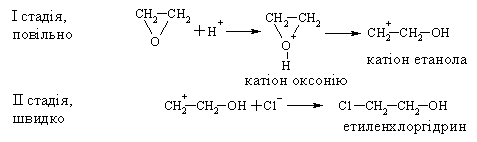 |