2.1.2 Методи добування алканів
Промислові методи добування визначаються, насамперед, наявністю природних сировинних джерел: нафти, природного газу та вугілля. Нафта являє собою суміш великої кількості органічних речовин, що мають різні температури кипіння. Тому при первинній ректифікаційній пе-регонці (багатократне збагачення пари, що піднімається вгору по ректифі-каційній колонні низькокиплячими компонентами, а рідини, що стікає вниз – висококиплячими компонентами) отримують не індивідуальні органічні сполуки, а нафтові фракції:  Головним критерієм ефективності технології переробки сирої нафти („глибини” переробки) є виділення світлих дистилятів: 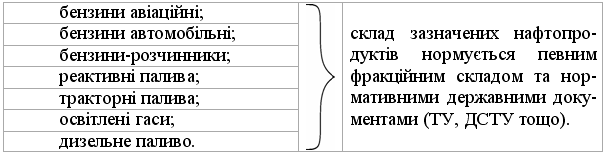 На українських нафтопереробних заводах (НПЗ) глибина переробки не переищує 60-70 %, тоді як у США вона складає більше 90 %. Один із шляхів підвищення виходу світлих нафтопродуктів є впрова-дження каталітичного крекінгу та переробка кубових залишків, що зали-шаються після відгонки світлих дистилятів. Розділити кубові залишки (ма-зути) на фракції можна лише при зниженні тиску, (вакуумній перегонці). При цьому використовують різні технологічні схеми:  Масляні дистиляти використовуються для виготовлення дистилятних олив та пластичних мастил. З гудрону (напівгудрону) отримують найбільш в’язкі залишкові оливи та товарний бітум. Каталітичний крекінг – це сучасне виробництво високоякісного ба-зового бензину (октанове число 85). Процес проводять при температурі 450-520 °С та тиску 1-2 атм. у присутності алюмосилікатних каталізаторів. Їх готують активуванням бентонітових або каолінових глин (вміст Al2O3 > 30 % мас.) кислотами або солями металів Al2(SO4)3, AlCl3 для вилучення надлишкової кількості катіонів металів та створення пористої структури. При подальшому прожарюванні (450-500 °С) вилучається кристалізаційна вода та утворюється розгалуження (каталітична) структура алюмосиліка-тів. Сам процес розщеплення важких вуглеводнів на легкі (бензинова фра-кція – С5-С11) можна представити за схемою: 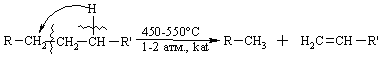 Алкани розгалуженої будови застосовують для добування високоок-танових бензинів, а алкени – на виробництво поліетилену, поліпропілену та інших полімерів. Вищі олефіни (olefins) гідрують для збільшення вихо-ду бензинової фракції: 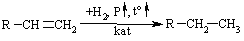 Паралельно відбуваються складні реакції ізомеризації та циклізації. Природний газ має такий склад: С1 (метан) 95 % об., решту скла-дають вуглеводні С2-С4. Їх використовують як побутове та промислове па-ливо та як сировину для нафтохімічного синтезу. У першому випадку при-родну суміш безпосередньо використовують як цільовий продукт. Так зріджений газ (С3-С4) використовують як більш екологічне паливо у дви-гунах внутрішнього згоряння; рідкий метан, як криогенне паливо для над-звукових транспортних літаків, яке переважає традиційний гас (керосин) за теплотою згоряння на 12-14 %. При виділенні з природного газу індивідуа-льних компонентів використовують значну різницю у їх температурах ки-піння. При цьому використовують різні технології. Наприклад, для отри-мання метану з виходом 99,99 % застосовують процес низькотемператур-ної ректифікації: 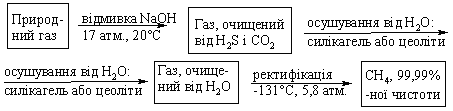 Вуглеводні С2-С5 для нафтохімічного синтезу розділяють традицій-ними методами: абсорбційним, компресійним та конденсаційно-ректифікаційним. Кам’яне вугілля гідрують в автоклавах при 300 атм. та наявності ка-талізаторів: сульфідів та оксидів Fe, Mo, Ni, W (Бергіус, 1913 р.): 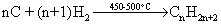 Для України, яка має значні запаси бурого вугілля, цей метод є важ-ливим та економічно привабливим. Оксосинтез за методом Фішера-Тропша (1922 р.) проводять у дві стадії: 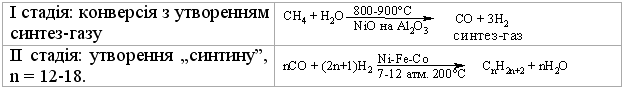 Лабораторні методи Реакцією Вюрца (Wurtz reaction) (1855 р.) – при дії металічного на-трію на моногалогенопохідні вуглеводні: 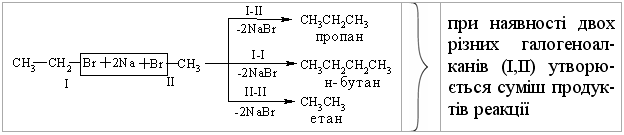 Реакційна здатність R–Hal змінюється в залежності від природи ато-ма галогену у ряду: R–I > R–Br > R–Cl, та від природи алкільного радикала R: первинний > вторинний > третинний. Причина у випадку зміни будови алкільного радикалу – стеричні перешкоди. Механізм реакції за П. Шоригіним: 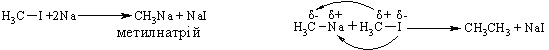 Гідрування алкенів та алкінів в присутності каталізаторів платинової групи (Pt, Pd, Ni): 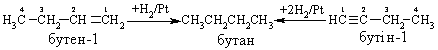 Термічне декарбоксилювання солей карбонових кислот, (реакція Дю-ма):  Реакція відбувається з відщепленням СО2, або карбонату лужного чи лужно-земельного металу та з утворенням алкану, який має на один атом карбону менше, ніж у вихідній солі карбонової кислоти. Електрохімічне декарбоксилювання солей карбонових кислот (метод Кольбе, 1849 р.). Електроліз солей карбонових кислот приводить до утво-рення алканів з парним числом атомів карбону. При цьому проходять по-стадійно такі перетворення:  Фізичні властивості алканів. При кімнатній температурі алкани С1-С4 – гази, С5-С16 – рідини, а починаючи із С17 – тверді речовини. Із збільшенням молекулярної маси температури плавлення та кипіння. зростають. Вуглеводні із парним чис-лом атомів карбону у гомологічному ряду (моноклінна кристалічна решіт-ка) плавляться вище, ніж сусідні вуглеводні із непарним числом атомів ка-рбону (ромбічна кристалічна решітка). Густина повільно зростає від 0,6261 (С5) до 0,8097 (С30), табл. 2.1. |