2.1.3 Будова алканів
В алканах атоми Карбону знаходяться у першому валентному стані (sp3-гібридизація). Орбітальну будову молекул метану та етану наведено на рис. 2.1. 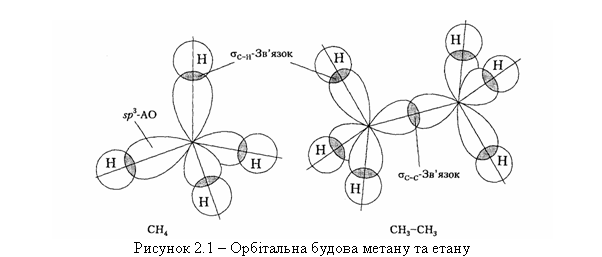 -Зв’язки в алканах утворюються при перекриванні орбіталей атома Гідрогену і гібридних sp3-орбіталей атома Карбону вздовж осі, що з’єднує ядра двох атомів (осьова симетрія), а -зв’язок – при бічному перекриванні р-орбіталей вздовж площини, що проходить через ядра двох атомів (пло-щинна симетрія). При цьому sp3-гібридна орбіталь має тетраедричну будо-ву. Характеристики хімічних зв’язків С–С та С–Н наведено в табл. 2.2. 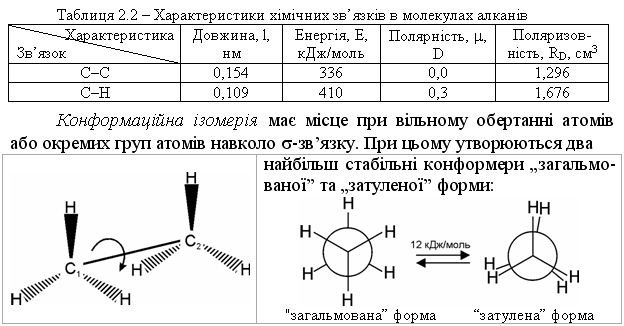 При обертанні навколо зв’язку С1-С2, наприклад, у молекулі етану, виникає відштовхування однакових атомів Гідрогену. Виходячи із цього посилання, енергетично більш вигідною є “загальмована” форма (мініма-льне відштовхування між атомами Гідрогену) у порівнянні із “затуленою” формою, де це відштовхування максимальне. Енергетичний бар’єр ротації однієї форми в іншу незначний – 12 кДж/моль, що у порівнянні майже до-рівнює енергії водневого зв’язку або енергії теплового руху молекул. Тому при звичайній температурі конформаційні ізомери розділити неможливо. |