2.4.3 Будова алкінів В алкінах атоми карбону біля потрійного зв’язку знаходяться у третьому валентному стані (sp-гібридизація). Орбітальна модель молеку-ли ацетилена наведена на рис. 2.10. 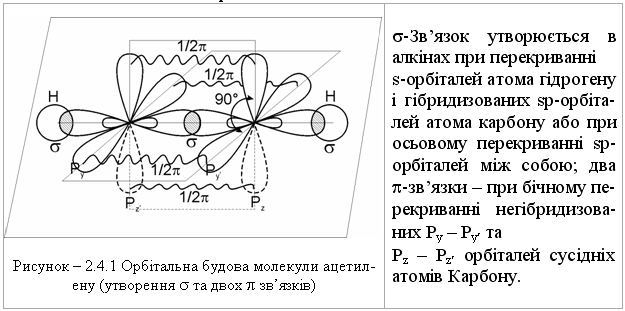 При цьому валентний кут між негібридизованими Py та Pz орбіталями складає 90 °, а сама молекула має лінійну будову: 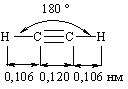 Порівняльна характеристика хімічних С–С зв’язків в алканах, алке-нах і алкінах наведена в табл. 2.11.  Наведені в табл.2.11 дані, які характеризують С-С-зв’язок насичених та ненасичених вуглеводнів показують, що із збільшенням кратності зв’язку його довжина закономірно зменшується, а енергія зв’язку зростає. При цьому різке збільшення поляризовності зв’язку та зменшення енергії -зв’язку від 271 кДж/моль у алкенах до 243 кДж/моль у алкінах вказує на суттєве збільшення реакційної здатності цих сполук. Це дає змогу зробити відносно алкінів наступні висновки: реакційним центром в алкінах виступає потрійний зв’язок, який має два легкодоступних з просторової точки зору -зв’язки; для алкінів, як і для алкенів, повинні бути характерними реакції еле-ктрофільного приєднання (АЕ); із збільшенням електронегативності sp-гібридизованого атома Кар-бону алкінів у порівнянні із sp2-гібридизованим атомом Карбону у алкенах, стають можливими для алканів реакції нуклеофільного приєднання (АN); збільшення електронегативності атома Карбону Сsp та зменшення довжини зв’язку –СС– (0,120 нм) приводить до появи слабкого кислотно-го характеру зв’язку в алкінах та до можливості реакцій замі-щення атома Гідрогену при Сsp-гібридизованому атомі Карбону на активні атоми металів (Li, Rb, Na, Cu, Ag). |